大阪市立大学研究生院医学研究科基因组免疫学的植松智教授和藤本康介助教等人组成的研究小组开发出了新型粘膜疫苗,不仅能控制全身粘膜的致死性感染,还可用来控制疾病特异性肠道细菌(专利号WO/2016/199904)。
以消化道为首的粘膜表面存在大量IgA,承担了粘膜免疫防御机制的部分功能,不过,此前并没有能将抗原特异性IgA自由诱导至所有粘膜表面的技术。该研究小组之前解析了肠道粘膜固有层的树突状细胞和IgA的诱导机制(Nat Immunol.2006, Nat Immunol.2008, J Immunol.2011),此次以解析结果为基础,研究了具有IgA诱导功能的肠道型树突状细胞末梢组织的诱导。
另外,随着以新一代测序仪为首的基因组解析技术的进步,研究人员积极实施了土著微生物菌群解析(尤其是肠道菌群解析)。近年来发现,肥胖、糖尿病、动脉硬化、炎症性肠病、类风湿性关节炎、大肠癌及帕金森症等各种疾病均与肠道菌群失调有关。另外还发现了与疾病发病直接相关的肠道细菌,像引起胃癌的幽门螺杆菌一样,有望通过除菌预防发病。不过,使用抗生素可能还会杀死有益细菌,从而加剧肠道细菌失调,因此需要开发能够仅特异性地去除致病性土著肠道细菌的方法。
在本次研究中,研究人员利用常见的先天免疫受体——Toll样受体9号配体CpG-ODN及Dectin-1配体curdlan(细菌的菌体成分),开发出了新型粘膜疫苗(图1)。利用该粘膜疫苗可以将抗原特异性记忆B细胞诱导至全身的淋巴结,并通过在粘膜表面增加抗原,来自由诱导抗原特异性IgA。
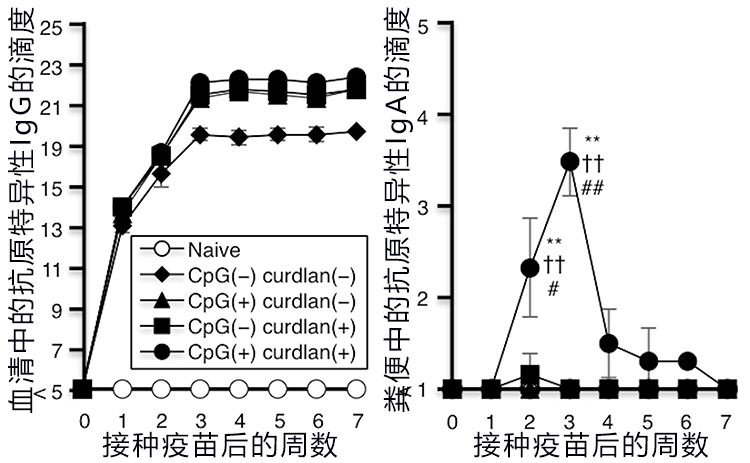
图1:接种疫苗后血清中的抗原特异性IgG及IgA的变化
众所周知,肺炎球菌性肺炎是日本社区获得性肺炎的主要原因,可能会发展成致死性感染。因此,研究小组考虑利用肺炎球菌抗原培育针对肺炎球菌的疫育,以控制肺炎球菌感染。接种疫苗6周后,经鼻腔投入肺炎球菌抗原后发现,支气管肺泡灌洗液中的抗原特异性IgG和IgA升高(图2A)。另外还确认,感染肺炎球菌后接种本次研发的新型粘膜疫苗的群组,肺炎球菌的定植受到抑制,未引起重症肺炎(图2B、C)。
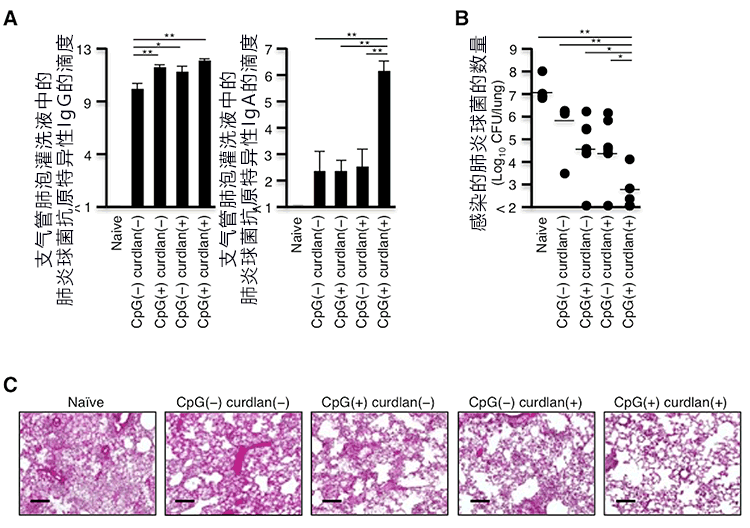
图2:针对肺炎球菌的新型粘膜疫苗能显著抑制肺炎球菌性肺炎
此外,有报告显示,肥胖和糖尿病患者体内的肠道土著细菌Clostridium ramosum增加,此次研究小组还针对这种细菌培育了特异性疫苗,为移植了肥胖患者粪便的限菌小鼠接种后发现,肥胖和糖尿病模型的情况得到显著改善(图3A、B)。
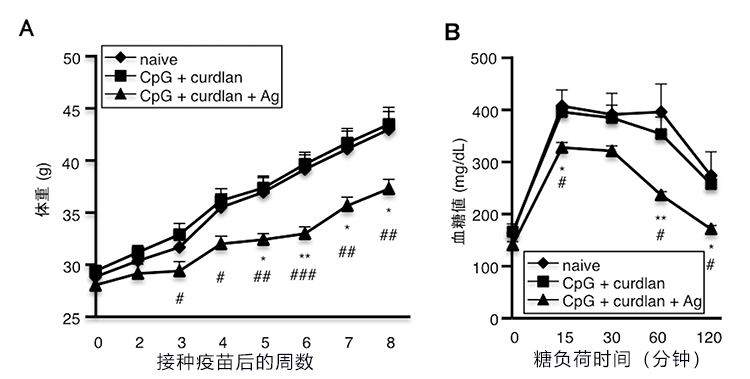
图3:为移植了肥胖患者粪便的限菌小鼠接种C. ramosum特异性疫苗后确认,通过高脂饮食诱导的肥胖和糖尿病得到控制
相关研究成果已于2019年8月21日发布在国际科学期刊《Gastroenterology》的网络版上。
文:JST客观日本编辑部翻译整理














