日本名古屋市立大学研究生院药学研究科生命分子构造学领域的加藤晃一教授与大阪大学研究生院工学研究科的内山进教授,着眼于控制体内免疫功能的抗体分子及其受体推进了联合研究,并全球首次发现,除了此前确认的结合位点外还存在新的结合位点。相关研究成果已于8月16日发布在以自然科学和临床科学的所有领域为对象的开放存取期刊《科学报告》(Scientific Reports)上。
研究成果的重点
细菌和病毒等异物侵入生物体内时,免疫功能会通过抗体发挥作用,消灭这些异物。基于这种功能,抗体作为生物药品得到了广泛利用。抗体通过Fab部分捕获异物,通过Fc部分与免疫细胞中的Fc受体结合。此前一直认为Fc受体正如其名称一样,只与抗体的Fc部分结合,但本次研究发现,除了抗体的Fc部分外,Fab部分也会与Fc受体结合。这项研究成果将改写免疫学教科书上描写的“Fc受体是抗体的Fc部分的受体”这种说法,同时,还有望提高作为癌症等的分子靶向药物使用的抗体药物的功能,作为新药开发的标靶也备受期待。
研究背景
我们的体内存在抵御外部异物入侵的免疫功能。尤其是血液中大量存在的蛋白质——抗体,在特异性识别细菌、病毒和癌细胞等之后,会与免疫细胞结合来激活免疫功能,消灭这些异物。要想发挥这些功能,抗体必须与免疫细胞中存在的Fc受体结合。
此前一直认为是抗体的Fc部分负责与Fc受体结合,并利用以往的物理化学方法,明确了抗体的Fc部分与Fc受体结合的情况。但之前的研究存在一个问题,即利用物理化学方法的研究环境与抗体在实际的生物体内发挥功能的环境大不相同。
治疗癌症等使用的抗体药物正是利用了抗体与免疫细胞结合介导的免疫功能,抗体与免疫细胞结合的强度直接关系到杀死异物的能力,因此这些分子的结合备受关注。
研究成果
本研究模拟了抗体实际工作的环境,并利用高速原子力显微镜,首次实时观测到了抗体与Fc受体结合的情形。另外,对结合强度进行计算发现,与抗体的Fc部分相比,包含Fab部分在内的全长抗体与Fc受体结合的强度明显更高(图A)。
接下来,研究小组为详细调查抗体与Fc受体结合的位点,利用氢氘交换质谱,成功确定了Fab部分与Fc受体结合的位点(图B)。
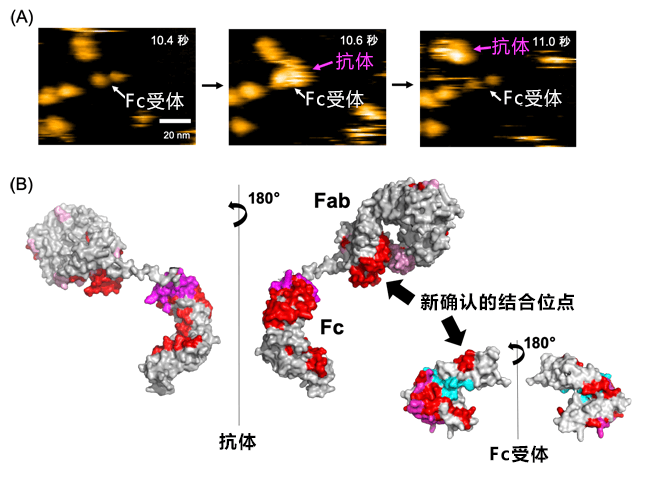
图:(A)利用高速原子力显微镜观察到的抗体与Fc受体结合的情形。实时观测到了抗体与Fc受体特异性结合并分离的情形。(B)利用氢氘交换质谱确认的抗体与Fc受体结合的位点。红色部分是抗体与Fc受体结合的位点。
以前的研究很难利用包含Fab部分和Fc部分在内的全长抗体进行解析,因此这是首次成功捕捉到之前被忽视的Fab部分与Fc受体的结合。此前认为仅与抗体的Fc部分结合的Fc受体实际上还与Fab区域结合,这个发现颠覆了免疫学的常识。
研究意义及未来展望
此前一直认为与免疫细胞的Fc受体结合的只有抗体的Fc部分,但此次的研究成果发现了Fab部分与Fc受体结合的可能性,并成功确定了Fab部分与Fc受体结合的新位点。
近年来,癌症等的治疗广泛使用了基于免疫功能的抗体药物。通过改变本次研究确认的结合位点,有望开发出较原来增强了功能的抗体药物。
文:JST客观日本编辑部翻译整理














