日本筑波大学医学医疗系的松本功副教授、住田孝之教授和藏田泉助教等人的研究小组发现了一组新的T细胞群,能控制类风湿性关节炎患者自身抗体的促炎功能。
研究发现,关节炎动物模型的淋巴结存在大量滤泡性T细胞(Tfh17细胞),这种细胞群会在关节炎初期产生白细胞介素(IL)-17,而且该细胞群的表面高度表达OX40分子。滤泡性T细胞会增加自身抗体的产生,并改变其促炎性,进行糖链解析后发现,IgG(免疫球蛋白G)的低唾液酸化会在疾病诱导期加剧。专家们认为,这种自身抗体通过形成免疫复合物,会比关节炎痊愈期间的抗体更多地释放TNFα等细胞因子,病因性较高。通过在体内抑制OX40路径,可使关节炎的症状减弱,Tfh17细胞减少,在B细胞中诱导唾液酸化的酶(St6gal1)出现恢复,自身抗体的唾液酸化得到改善。
在解析未进行治疗的类风湿性关节炎患者的末梢血液时发现,与骨关节炎患者相比,类风湿性关节炎患者体内表达OX40的Tfh17细胞更多,Tf17细胞数量与ACPA呈正相关,与浆母细胞St6gal1呈负相关。
以上结果表明,表达OX40的T细胞会负向调节自身抗体的唾液酸化,与类风湿性关节炎的病情恶化有关。
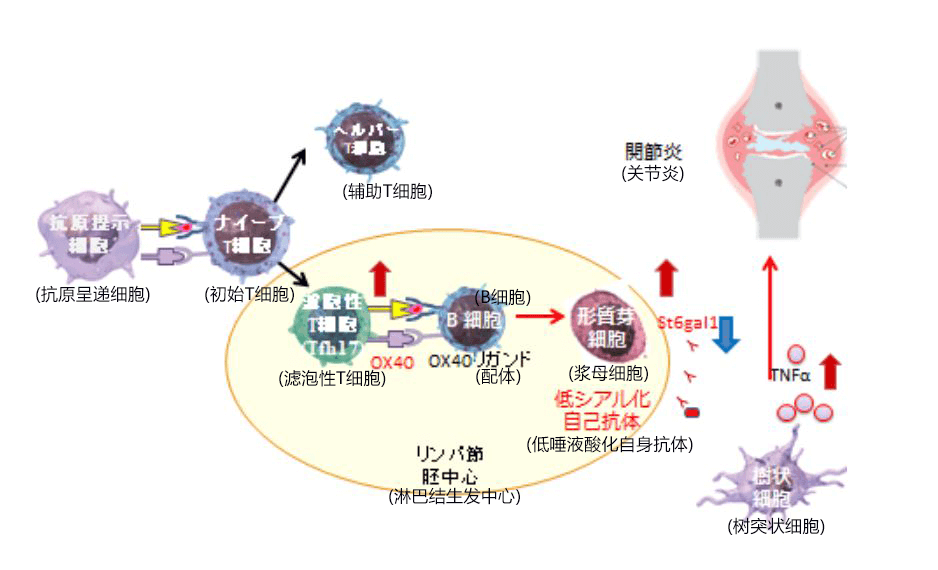
图:关节炎中通过OX40信号介导的Tfh17-B细胞恶化机制
淋巴结内的滤泡性T细胞(尤其是产生IL-17的Tfh17)会表达OX40,诱导B细胞向浆母细胞分化繁殖,并削弱St6gal1在细胞内的表达,同时促进大量诱导炎症性细胞因子的低唾液酸化自身抗体的产生。低唾液酸化自身抗体通过免疫复合物,强烈表达TNFα等细胞因子,从而诱发关节炎。
通过查明在类风湿性关节炎患者体内发现分子水平的OX40介导唾液酸化控制机制,有望开发出与直接控制细胞因子的治疗法完全不同的、不会引发感染症等的自身免疫特异性治疗方法。
文:JST客观日本编辑部翻译整理














