日本理化学研究所(简称“理研”)的研究小组发现名为“CAPON”的蛋白质与阿尔茨海默病的病情恶化有关。利用此次的研究成果,今后如能开发出新的抑制CAPON功能的药物或方法,就有望控制阿尔茨海默病情的发展。
关于阿尔茨海默病的发病机制,目前普遍认可的解释是“淀粉样蛋白级联假说”,即由于β-淀粉样蛋白肽(Aβ)沉积(淀粉样蛋白病理),导致聚集了Tau蛋白的神经原纤维缠结(Tau病理),最终造成神经细胞死亡。不过,此前一直不清楚从淀粉样蛋白病理到Tau病理及神经细胞死亡的转变机制。
此次,研究小组通过进行相互作用(Interactome)解析,发现CAPON会与Tau蛋白结合。另外还确认,在再现了人淀粉样蛋白病理的模型小鼠脑内强制表达CAPON的话,会加剧Tau病理及伴有神经细胞死亡的脑萎缩,反之,使再现了Tau病理和神经细胞死亡的模型小鼠缺少CAPON基因的话,能抑制脑萎缩。因此,可以认为CAPON是在淀粉样蛋白病理下诱导Tau病理和神经细胞死亡的重要因子。
相关研究成果已发布在英国在线科学杂志《自然通讯》(6月3日)上。
研究小组为调查与Tau病理形成有关的蛋白质,首先进行了相互作用解析,发现名为CAPON(C-terminal PDZ ligand of nNOS)的蛋白质会与Tau蛋白结合。虽然以前就知道CAPON会与nNOS(神经元型一氧化氮合酶)结合,在NMDA(N-甲基-D-天门冬胺酸)受体的介导下引发兴奋性毒性等,但一直不清楚其在阿尔茨海默病中发挥的作用。
研究小组此次在再现淀粉样蛋白病理的AppNL-G-F基因敲入(KI)小鼠脑内分析了CAPON的表达情况,发现CAPON聚积在海马体的锥体细胞层。另有报告显示,阿尔茨海默病患者的脑内也存在相同的现象,因此在淀粉样蛋白病理下,CAPON在海马体内的聚积被认为影响了之后的阿尔茨海默病病理。
接下来,研究小组制作了以与人脑相同的样式表达Tau蛋白的MAPT KI小鼠。然后,使AppNL-G-F KI小鼠与MAPT KI小鼠交配,获得双KI小鼠,并利用腺相关病毒载体使CAPON在双KI小鼠体内过表达。试验结果发现,小鼠出现了Tau病理和神经细胞死亡,海马体萎缩(图1)。
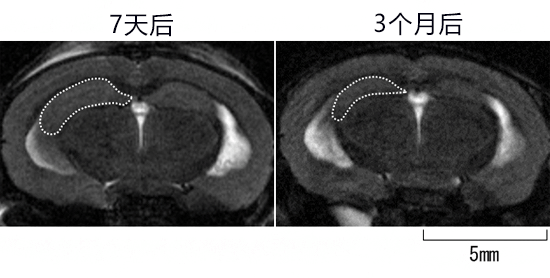
图1:CAPON过表达小鼠的大脑MRI图像
利用腺相关病毒使CAPON基因在AppNL-G-F KI和MAPT KI的双基因敲入小鼠体内过表达,7天后和3个月后拍摄了MRI图像。从图像中发现,使CAPON过表达3个月后,海马体明显萎缩。
另外,研究小组还调查了诱导神经细胞死亡的机制,发现不仅是表示细胞程序性死亡的细胞凋亡标志物,表示细胞炎症性死亡的细胞焦亡标志物也增加。因此,可以认为是经过复杂的机制、而非单一路径诱导了神经细胞死亡。
此外,研究小组从再现了Tau病理和神经细胞死亡的P301S-Tau转基因小鼠(P301S-Tau-Tg)体内敲除(缺损)CAPON基因后,发现抑制了脑萎缩(图2)。
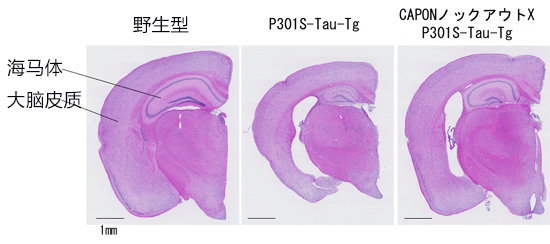
图2:敲除了CAPON基因的X P301S-Tau-Tg小鼠的大脑
右侧的图像是CAPON基因敲除小鼠与P301S-Tau-Tg小鼠交配后诞下的小鼠的脑切片(H&E染色图像)。从图中可以看出,P301S-Tau-Tg小鼠(中间的图像)出现的脑萎缩现象通过使CAPON缺损得到了明显抑制。另外,在右侧图像中还可以看出,神经细胞死亡发白的部分减少,海马体和大脑皮质的尺寸及厚度也没有像中间的图像那样缩小。
根据以上结果,可以认为CAPON是在淀粉样蛋白病理下诱导Tau病理和神经细胞死亡的重要因素。
(日文全文)
文:JST客观日本编辑部














