日本东邦大学的中野裕康教授带领的研究小组利用新开发的转基因小鼠确认,小鼠胎儿期小肠上皮细胞的坏死性新细胞死亡会引发严重的小肠炎。这项成果有望用来查明人类新生儿的严重坏死性肠炎的发病机理,还有助于开发新的治疗方法。
研究背景
在人类的身体中,部分细胞适当死亡对保持身体的正常状态至关重要,但细胞过度死亡的话就会引发各种疾病。众所周知,细胞存在名为细胞凋亡的程序性死亡现象,但近年来发现还存在其他类型的细胞死亡。坏死性凋亡与程序性凋亡一样,是受到调控的细胞死亡,不过,与程序性细胞凋亡不同的是,坏死性凋亡的细胞膜在早期就会破裂死亡,因此细胞释放出来的物质可能会在周围引发严重的炎症。研究表明,坏死性凋亡与心肌梗塞、脑梗塞和病毒感染细胞的消除等有关,但此前一直不太清楚体内发生坏死性凋亡后会诱发什么样的反应。
研究成果
因此,中野教授等人的研究小组为了以个体水平对发生坏死性凋亡后的生物反应进行解析,开发了让诱导坏死性凋亡的基因cFLIPs过度表达的小鼠。研究发现,部分cFLIPs过表达小鼠在子宫内死亡。研究小组进行组织学解析确认,尽管cFLIPs在全身的器官中表达,但只有小肠会发生严重的炎症。在小肠中发现了小肠上皮细胞脱落和微绒毛短小化的现象,确认发生坏死性肠炎(图1A)。另外还发现,在小肠上皮细胞中,部分细胞如预期那样诱发了坏死性凋亡(图1B),但令人吃惊的是,大量小肠上皮细胞发生程序性细胞凋亡,并脱落到肠道中(图1C)。通过进一步进行详细解析确认,坏死性凋亡细胞释放出了炎症诱导物质(总称为DAMPs),诱导名为3型天然淋巴细胞(ILC3)的特殊淋巴细胞聚集到小肠中,ILC3在小肠中被进一步激活,产生这种细胞的细胞因子之一——白细胞介素(IL)-22的表达增加。
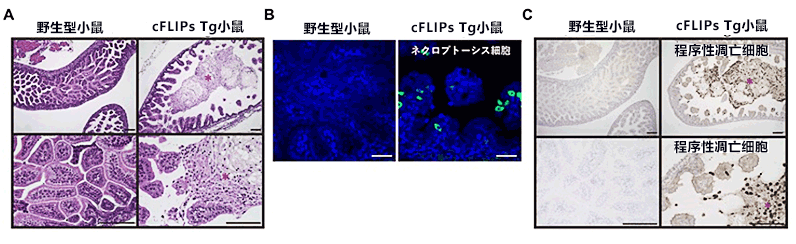
图1:cFLIPs Tg小鼠发生严重的小肠炎
(A)小鼠胎儿的小肠组织图像。胎儿时期的野生型小鼠的小肠内腔(内侧)几乎全被绒毛覆盖(左)。cFLIPs Tg小鼠的小肠绒毛变得非常短,上皮细胞脱落,内腔存在大量死亡的小肠上皮细胞(右,红色星号)。
(B)野生型小鼠的小肠内未出现坏死性凋亡细胞(绿色),而cFLIPs Tg小鼠的小肠上皮细胞出现坏死性凋亡细胞(绿色)。
(C)野生型小鼠的小肠内几乎未出现程序性凋亡细胞(茶色),而cFLIPs Tg小鼠的小肠内侧(红色,星号)出现大量程序性凋亡细胞(茶色)。
横线长代表100μm。
为明确小肠炎的发病机理,研究小组去除ILC3和IL-22后发现,虽然抑制了程序性凋亡细胞的出现,但并没有抑制坏死性凋亡细胞的出现。通过以上结果首次明确,胎儿的小肠内在发生坏死性凋亡后又发生了其他反应,即发生坏死性凋亡的小肠上皮细胞激活了ILC3,被激活的ILC3产生IL-22,诱发小肠上皮细胞发生程序性细胞凋亡(图2)。
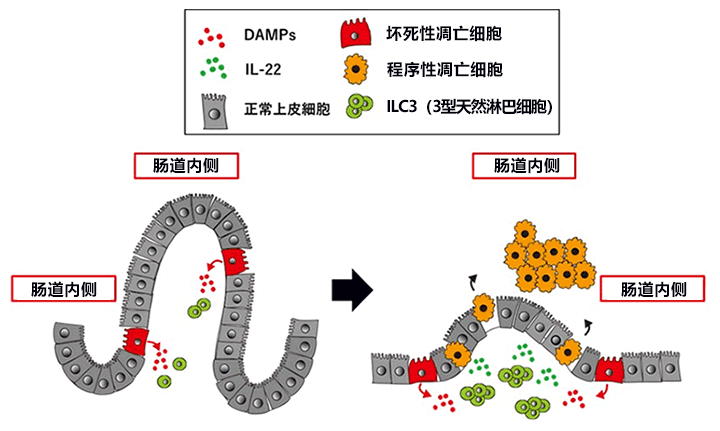
图2:坏死性凋亡细胞引发小肠炎的机理
cFLIPs过度表达的部分小肠上皮细胞被诱发坏死性凋亡(细胞,红色),释放出了DAMPs(炎症诱导物质,红点)。ILC3(3型天然淋巴细胞)对其作出反应,向小肠内移动(左)。移动到小肠内的ILC3被激活,分泌IL-22(绿点)。分泌的IL-22作用于小肠上皮细胞。收到IL-22信号的小肠上皮细胞发生程序性细胞凋亡,脱落到小肠内侧(右)。结果导致小肠的绒毛变得非常短。
未来展望
此次开发的小鼠模型是使cFLIPs基因过度表达的模型,不过在胎儿时期的未成熟环境中,缺血等也极有可能诱导小肠上皮细胞发生坏死性凋亡。众所周知,人类的新生儿、尤其是早产儿有时会发生严重的坏死性肠炎。其原因可能是肠道供血不足造成的缺氧等,不过具体原因尚未完全查清。此次制作的小鼠胎儿的小肠炎组织图像与人类新生儿发生的坏死性肠炎相似,所以,此次的研究成果有望用来查明人类新生儿发生坏死性肠炎的原因,还有助于开发新的治疗方法。(日文原文)
文:JST客观日本编辑部














