顺天堂大学医学研究科基因组与再生医疗中心的赤松和土特聘教授、志贺孝宏研究员,和庆应义塾大学医学部生理学教研室的岡野荣之教授、西原浩司助教等带领的共同研究团队,通过向人工诱导多功能干细胞(iPS细胞)培养基中添加3类小分子化合物,成功使iPS细胞的分化和成熟能力得以显著提高[1]。该新技术成果已于2019年1月31日公开发表在国际干细胞学会(ISSCR)的官方科学杂志《Stem Cell Reports》上[参考文献1]。
由于iPS细胞能够被诱导分化成各类不同的细胞组织,所以在其发现十多年来迅速被广泛应用于再生医疗、新药开发、疾病机理研究等。从2014年在眼疾领域首次开启临床试验后,更是在2018年进入井喷态势(图1)。但是iPS细胞的制备较为耗时,每个细胞株的分化成熟能力迥异,所以在再生医疗应用前必须先甄别筛选出分化成熟能力较强的高效细胞株。这些繁琐的操作导致目前iPS细胞应用中耗费大量人力、物力和时间的不足。
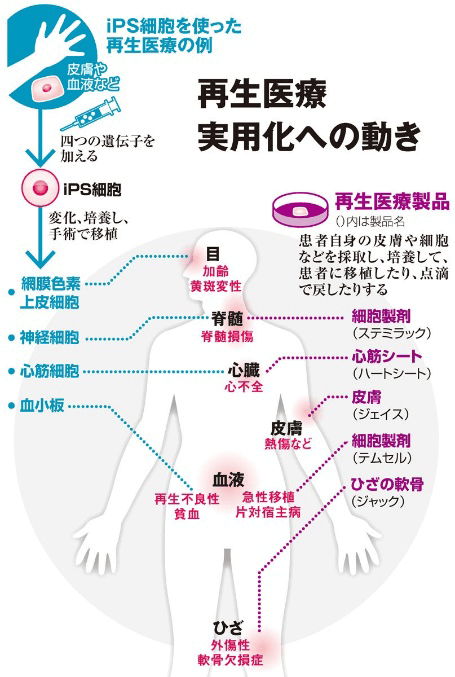
图1 iPS细胞再生医疗实用化动向 (《朝日新闻》)
本次研究中,科研团队利用小鼠体细胞制备IPS细胞时,向处于重编程阶段(reprogramming period)的体细胞培养体系中添加了MEK抑制剂(PD184352)、GSK3β抑制剂(CHIR99021)、FGF受体抑制剂(SU5402)三类小分子化合物。发现和未添加化合物的对照组相比较,添加后所有细胞株的分化诱导时间整体缩短,分化成熟早期的标志基因表达显著增强(图2)。而且,当重编程阶段结束后再添加上述三类化合物,对整体分化和成熟能力的提高不会产生明显影响。
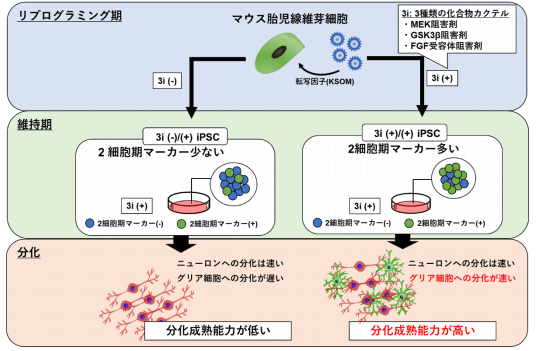
图2 添加3i后iPS分化成熟能力提高 (新闻稿)
在疾病治疗的临床实践中,与时间赛跑是至关重要的一点。但是目前人工诱导后的iPS细胞,和正常体内干细胞相比,成熟为最终分化目的细胞的时间往往更长。而且即使同一供体的体细胞在相同的制备条件下,得到iPS细胞的分化成熟能力也大不相同。再生医疗实践中,未分化的iPS细胞将来有形成肿块的风险,所以先花费大量时间进行高效iPS细胞均一化筛选。
本实验中,由小鼠体细胞制备出的iPS细胞先成熟为神经干细胞,再继而最终分化成神经元和神经胶质细胞。以往常规的iPS细胞制备方法,得到的神经干细胞分化为神经胶质细胞的能力极低。而当在重编程阶段添加3类化合物后,神经干细胞短时间内即获得了分化成神经胶质细胞的能力(图3)。实验同时证明,重编程阶段的培养条件和重编程阶段完成后的培养条件相比,对iPS细胞最终分化和成熟能力的决定性更大。
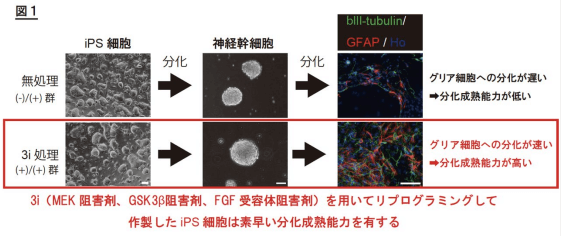
图3 神经干细胞分化成熟为胶质细胞能力提高 (新闻稿)
另外,一般说来哺乳动物胚胎发生需要经历受精卵到2细胞期、4细胞期、8细胞期…囊胚期等的阶段化发育。但本实验中当添加3类化合物后,所制备得到的iPS细胞显著增加了2细胞期的特有标志性基因群的表达。尽管目前该跃进机理还不明确,但可以肯定的是重编程阶段培养条件的改变导致了特征基因表达模式的改变。
本研究从一个全新的角度,通过改变重编程阶段的培养条件来促进iPS细胞的分化和成熟。期待该技术最终能运用到再生医疗实践中,提高iPS细胞的制备和分化速度,和患者一道跑赢病魔。
供稿 宋傑 东京大学博士
编辑修改 JST客观日本编辑部
参考文献:
1.Koji Nishihara, et al.Induced pluripotent stem cells reprogrammed with three inhibitors show accelerated differentiation potentials with high levels of 2-cellstage marker expression. Stem Cell Reports. https://doi.org/10.1016/j.stemcr.2018.12.018













