肥胖会引发糖尿病(胰岛素抵抗性糖尿病)、高血压和高血脂等多种生活方式病,因此预防和消除肥胖成为亟需解决的课题。尤其是因为肥胖导致胰岛素分泌不正常,血糖值无法降低的胰岛素抵抗性糖尿病,患者数量一直在持续增加。据推算,日本的糖尿病患者数量约为1,000万人。
然而,肥胖的控制比较复杂,业界一直期待查明肥胖的机制,发现有助于开发新型抗肥胖药物的“肥胖调节分子”。众所周知,肥胖不仅是脂质在组织中堆积,脂质本身也与肥胖和生活方式病的病情发展有直接关系,但至今为止一直未能查清肥胖的整体控制机制。
东京大学、大阪药科大学、第一药科大学和筑波大学组成的研发小组此前发现,前列腺素D2(PGD2)会抑制脂肪细胞中堆积的脂肪分解(Biochem. Biophys. Res. Commun. 490: 393,2017)。另外还发现,在肥胖小鼠的脂肪组织中,生物合成PGD2的L型酶(L-PGDS)的基因表达会升高。
因此,为调查L-PGDS和PGD2在肥胖控制中的作用,研发小组培养了脂肪细胞中无法特异性形成L-PGDS的小鼠并进行了分析。
研发小组向正常小鼠和脂肪细胞中无法形成L-PGDS的小鼠投喂了11周的普通食物或高脂肪食物,投喂普通食物时,二者的肥胖程度和脂肪细胞尺寸没有出现差异,而投喂高脂肪食物时,脂肪细胞中无法形成L-PGDS的小鼠与正常小鼠相比,体重的增加减少20%以上,内脏和皮下脂肪量减少,单个脂肪细胞的尺寸也减小(图1)。
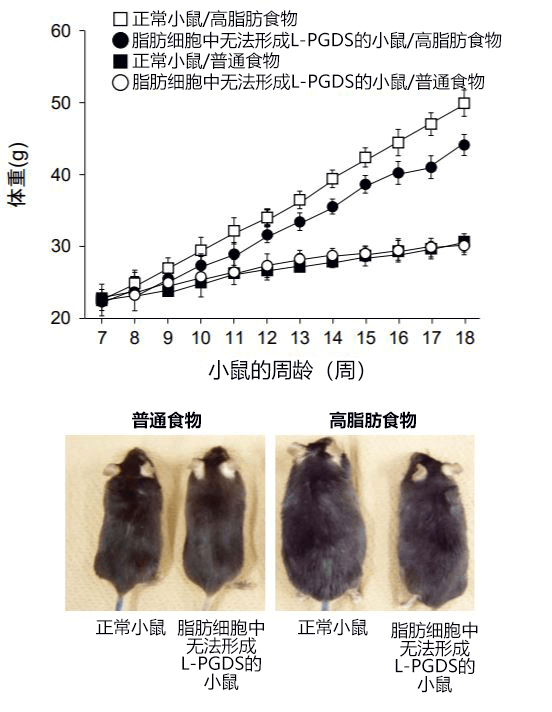
图1:脂肪细胞中没有L-PGDS的小鼠控制了体重增加
另外,在脂肪细胞中无法形成L-PGDS的小鼠体内,了解脂肪细胞分化程度的各种标记基因和参与脂肪酸生物合成的很多基因的表达水平均降低。脂肪细胞中无法形成L-PGDS的小鼠与正常小鼠相比,血液中的胆固醇、脂质和葡萄糖的值降低,这些在代谢综合征中出现异常的血液值也得到改善。
另外,此前已经知道,巨噬细胞会浸润肥胖的脂肪组织,并引起炎症,但此次发现,在脂肪细胞中无法形成L-PGDS的小鼠体内,诱导炎症的巨噬细胞标记基因F4/80和CD11c的表达水平降低,作为糖尿病指标的胰岛素敏感性也得到改善。
文 JST客观日本编辑部
日文发布全文 [网址]














