东京都立大学研究生院理学研究科的广田耕志教授、侯赛因·MD·巴耶济德(研究生)、川澄辽太郎助教的研究团队发表研究成果称,已揭示出人类细胞抵御核苷类似物之一的“阿洛夫定”细胞毒性的分子机制。研究发现,参与DNA复制的核酸酶“FEN1”可通过清除进入细胞的阿洛夫定,发挥降低其细胞毒性的作用。该发现有望推动基于新机制的抗癌药物的开发。相关研究成果已发表在《Nucleic Acids Research》的7月18日刊上。
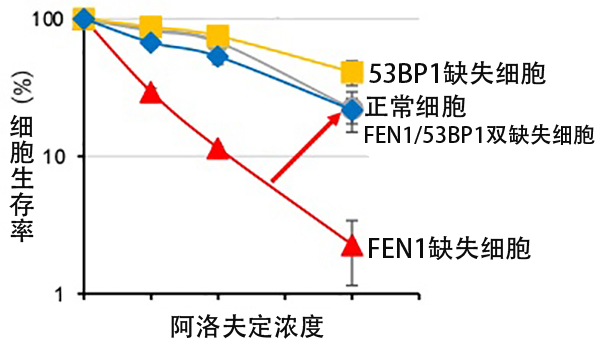
图1 编码名为53BP1的DNA修复酶的基因同时缺失时,细胞状态可恢复至接近正常细胞水平(供图:东京都立大学)
核苷类似物是一类结构与DNA原料——核苷高度相似的化学物质的总称,自1980年代起就被用于治疗HIV等病毒感染性疾病以及白血病等癌症。因其与DNA原料相似,会在DNA复制过程中被整合到新合成的基因组DNA中,从而抑制复制反应。由于其能够更强效地抑制复制频率高且反应准确性低的病毒和癌细胞的复制反应,因此常被用于相关治疗。然而,其具体分子机制此前一直未明确。
此前,广田教授等人一直致力于研究细胞抵御各类核苷类似物细胞毒性的分子机制。研究发现,不同核苷类似物会呈现完全不同的细胞毒性,且降低其毒性所需的DNA修复因子也各不相同。研究团队旨在开发出能特异性“精准靶向”癌症中DNA修复因子突变的新一代治疗方法。
此次,研究团队利用24种与DNA修复相关的基因变异体,检测了阿洛夫定对细胞增殖的抑制程度。
结果表明,在DNA复制反应中负责切割DNA的酶基因——“FEN1(在滞后链合成时逐个切割新生链末端的flap结构以促进高效连接的酶)”的变异细胞对阿洛夫定表现出高细胞毒性。此外,在FEN1基因缺失的细胞中,经阿洛夫定处理后的复制速度显著下降。
另一方面,这种复制速度的减慢在同时缺失编码DNA修复酶53BP1基因的情况下,可基本恢复至正常细胞水平。研究发现,在FEN1缺失的细胞中,阿洛夫定在DNA复制过程中会异常蓄积在基因组内,进而导致53BP1异常蓄积,最终引发DNA损伤。
去年,研究团队曾发现,细胞对阿洛夫定毒性的抵抗性与同源重组反应必需的BRCA基因相关。
为明确其关联性,研究团队制备了FEN1与同源重组同时受损的细胞,对其关联性展开了研究。
结果显示,与仅单一功能受损的细胞相比,双缺失细胞对阿洛夫定的抵抗性大幅下降。这表明,FEN1可独立于同源重组机制,发挥抵御阿洛夫定细胞毒性的作用。
由于FEN1基因突变及表达异常常见于多种癌症,该研究成果有望应用于FEN1基因突变型癌症的治疗。
广田教授表示:“我们发现,用于治疗病毒感染性疾病的核苷类似物,不同药物所需的DNA修复因子各不相同。这一点可称为癌症的‘阿喀琉斯之踵’(致命弱点),有望为开发针对DNA修复弱点的新型癌症治疗方法奠定基础。本次研究证实,阿洛夫定这类药物对FEN1修复因子存在异常的癌症具有特殊疗效。未来,我们计划进一步检测更多药物的效果,推动核苷类似物成为癌症治疗的核心药物。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nucleic Acids Research
论文:The flap endonuclease-1 promotes cellular tolerance to a chain-terminating nucleoside analog, alovudine by counteracting the toxic effect of 53BP1
DOI:10.1093/nar/gkaf617