东京科学大学综合研究院细胞控制工学研究中心的博士生李子洋(研究当时)和中户川仁教授等人的研究团队,成功解明了因细胞核自噬(选择性降解细胞核的自噬途径,即细胞核自噬)失调而导致细胞死亡的机制。相关研究成果已发表在期刊《Nature Communications》上。
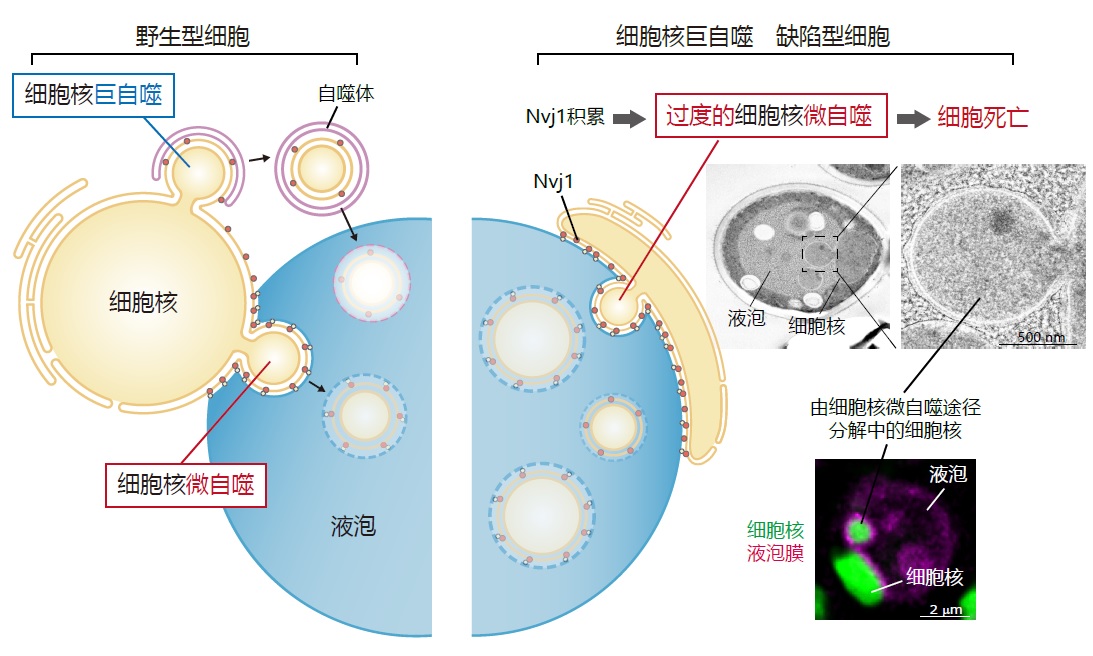
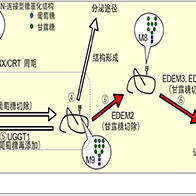
图1 阐明了由于细胞核巨自噬(一种降解部分细胞核的自噬途径)失调而引发细胞死亡的机制。当细胞核巨自噬停止时,细胞核微自噬被过度激活,从而导致细胞死亡(供图:东京科学大学)
在酵母细胞中,细胞核自噬存在“巨自噬”和“微自噬”两种途径。微自噬过程中,溶酶体或液泡的膜向内凹陷,将待分解的物质直接包裹并降解。而巨自噬则通过自噬小体(一种膜结构)先包裹降解目标,然后运送至溶酶体或液泡进行分解。
研究团队此前的研究表明,酵母细胞内存在一种通过巨自噬降解细胞核的选择性机制,即细胞核巨自噬(Macro-Nucleophagy)。细胞核是负责储存和复制基因组DNA并执行基因表达的关键细胞器,而在细胞核巨自噬的过程中,Atg39蛋白介导细胞核部分区域被自噬小体包裹,并最终在液泡内降解。
敲除Atg39蛋白的细胞在营养匮乏环境下会出现细胞核形态异常,并比野生型细胞更早降低存活率,这表明细胞核巨自噬对适应营养缺乏至关重要。然而,为什么在营养匮乏时需要降解部分细胞核?以及细胞核巨自噬的停止如何引发细胞核形态异常和生存率下降?这些问题仍然未解。
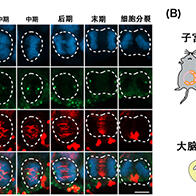
研究团队利用荧光成像分析发现,在营养匮乏状态下,Atg39敲除细胞的细胞核巨自噬停止时,细胞核内容物会形成巨大结构体并被液泡内吞。在此过程中,液泡膜向内凹陷,将来自细胞核的结构体吞入液泡内部。进一步研究发现,敲除细胞核微自噬所需的Nvj1蛋白时,这一吞噬过程被阻断,这说明细胞核巨自噬的停止会导致细胞核微自噬的过度亢进。
核膜蛋白Nvj1在营养匮乏状态下,会被Atg39依赖性的细胞核巨自噬所降解,在此次研究的Atg39敲除细胞中,Nvjl大量积累导致了细胞核微自噬被过度激活。这表明在正常细胞中,细胞核巨自噬抑制了细胞核微自噬的失控。进一步的研究证实,当通过敲除Nvj1来使过度激活的细胞核微自噬停止时,Atg39敲除细胞中的细胞核形态异常和存活率下降的情况几乎完全恢复。换言之,该研究证明了细胞核巨自噬的停止会导致细胞核微自噬的异常活化,甚至产生致命影响;而抑制细胞核微自噬过度活化是细胞核巨自噬的重要功能之一。
相对于出芽酵母的细胞核(直径约1.5~2微米),细胞核巨自噬所降解的部分很小(小于0.15微米),而失控的细胞核微自噬所降解的部分非常大,直径可超过1微米,甚至包含DNA结合蛋白和核小体蛋白。因此,当细胞核微自噬失控时,可能造成细胞生存所必需的关键核成分被液泡吞噬,影响细胞的基本存活功能;或可致核内基因表达受损,使细胞无法适应营养匮乏的环境,最终走向死亡。
此次研究揭示了细胞核自噬失控与细胞死亡之间的关系,表明受控的细胞核自噬对细胞稳态至关重要。该发现不仅为理解自噬相关疾病提供了基础信息,也为未来的疾病研究和干预策略奠定了科学基础。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Communications
论文:Macronucleophagy maintains cell viability under nitrogen starvation by modulating micronucleophagy
DOI:10.1038/s41467-024-55045-9