神户大学生物信号综合研究中心的蜷川晓助教、松尾将生(硕士生),京都大学研究生院理学研究科的森和俊教授(研究当时)、邓樱(研究当时为硕士生)、自然科学研究机构生命创成探究中心的加藤晃一教授以及名古屋市立大学研究生院药学研究科的矢木宏和副教授等组成的研究团队宣布,发现了蛋白质在内质网中的命运是通过糖链介导的结构形成因子和降解因子之间的“拔河”作用来决定的。这一发现得益于对内质网中促进蛋白质结构形成的糖链修饰酶“UGGT1”的功能研究。预计该研究成果将有望助力新型疾病治疗和预防方法的开发。相关研究成果于2024年12月10日发表在国际学术期刊《eLife》上。
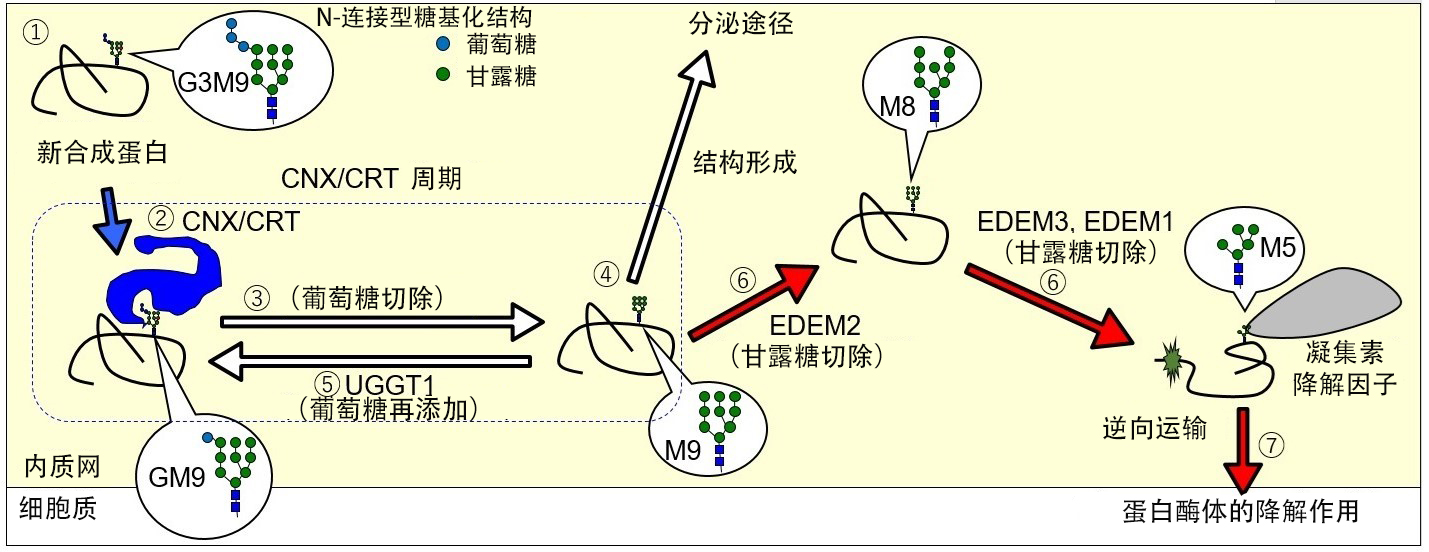
图1以N型糖链为中心的内质网蛋白质质量控制机制概要图(供图:神户大学)
内质网是细胞内的一个重要细胞器,负责合成包括膜蛋白和分泌蛋白在内的分泌途径蛋白质群在内的约三分之一的全蛋白质,其中约80%的蛋白质被添加了N型糖链,并通过这些糖链介导精密的质量控制机制。
此前的研究表明,内质网中蛋白质的结构和降解途径因N型糖链的存在与否而有显著差异。
N型糖链由三个葡萄糖(G)和九个甘露糖(M)(即G3M9)组成,通过切除糖基转化为GM9后,其结构被特异性分子伴侣CNX或CRT识别,进而促进蛋白质的结构形成。如果结构形成,则蛋白质继续进入分泌途径;如果结构未能形成,那么糖基修饰酶UGGT1会重新附加葡萄糖,启动新一轮循环。而当蛋白质始终无法形成结构时,EDEM2切除N型糖链中的甘露糖,最终被识别并导向分解。此前尚不清楚在这种机制中,蛋白质的命运是如何被决定的。
长期以来,UGGT1被认为仅与结构形成相关,对降解时机无直接影响,但这一点尚缺乏完全证明。
为验证此假设,研究团队制作了UGGT1基因敲除细胞(KO细胞)。
结果发现,在UGGT1-KO细胞中,与对照细胞相比,分解基质膜蛋白ATF6的N型糖链未重新附加葡萄糖,其分解显著加速,表明糖链修饰酶UGGT1抑制了蛋白质的分解。
此外,UGGT1对结构稳定、半衰期长的蛋白质没有明显影响,但对结构不完整或不稳定的蛋白质,UGGT1能抑制其降解。
研究团队总结了以往的研究结果,确定结构形成因子和降解因子的数量平衡决定了蛋白质趋向形成结构还是降解。通过糖链介导的结构形成和降解因子的“拔河”作用,决定了内质网中蛋白质的命运。
内质网功能与阿尔茨海默病、癌症和糖尿病等60多种人类疾病密切相关。此次研究成果为未来开发新疗法及预防策略奠定了重要基础。
蜷川助教表示:“很高兴能够解开小胞体的蛋白质在内质网中进行生物合成后,究竟是形成结构还是被降解这一命运决定机制,这是一个极其重要的过程。特别是发现原本被认为完全不参与分解过程的UGGT1竟然能够显著抑制ATF6及其他不稳定蛋白的分解,这一结果让我们感到十分惊讶。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:eLife
论文:UGGT1-mediated reglucosylation of N-glycan competes with ER-associated degradation of unstable and misfolded glycoproteins
DOI:10.7554/eLife.93117