2025年12月25日,日本东海大学医学部的龟谷美惠客座副教授等人的研究团队宣布,成功开发出可再现个体化人类免疫反应的下一代“免疫人源化小鼠”模型。该模型通过使用体内持续产生IL-4(白细胞介素4)的小鼠,实现了人类B细胞的长期维持,并成功在其表面产生高功能的人源IgG抗体。同时在小鼠体内(脾脏)确认形成了与人类淋巴组织相似的结构。该成果有望应用于抗体药物候选物评估及癌症疫苗评价研究。相关研究成果已发表在《Frontiers in Immunology》的2025年11月26日刊上。
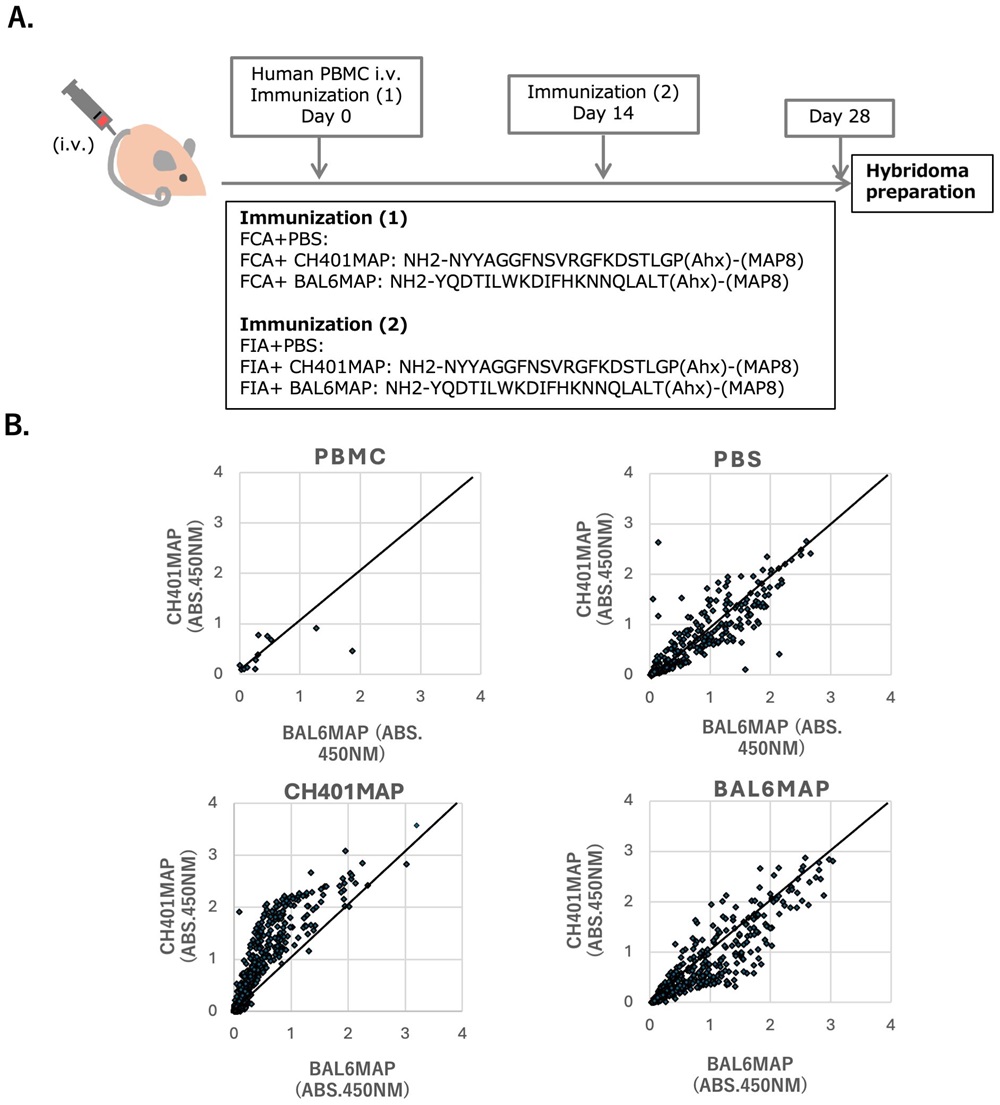
图1 分泌IgG抗体的B细胞杂交瘤制备流程(供图:东海大学)
随着免疫检查点抑制剂和癌症疫苗等利用人类免疫反应的治疗方式不断扩展,人们对能够在治疗的前更准确再现个体化人类抗体应答的前临床动物模型的需求也日益增加。
然而,既往使用的免疫缺陷小鼠模型中人类B细胞存活时间短,难以对诱导产生抗体特异性IgG的效果进行有效评估。
人类B细胞是一种能够识别病原体、产生抗体以保护机体的淋巴细胞,约占血液成分的5%~10%。特异性IgG是免疫球蛋白的一种,可对特定抗原产生反应,其被分为五类(IgM、IgD、IgG、IgA、IgE),其中IgG主要承担排除病原菌的功能,并广泛应用于临床免疫治疗等领域,被认为是实用性最高的抗体类型。
本次研究团队将人类外周血单个核细胞(PBMC)移植至全身表达人源IL-4的转基因NOG小鼠体内,探索了重建个体化人类免疫系统的可能性。IL-4由活化T细胞、肥大细胞及巨噬细胞产生,承担信号传导功能并调控抗体生成。
既往研究已证实,采用外周血中的免疫细胞进行PBMC移植的人源化小鼠模型,会因小鼠体内仅有人类T细胞被快速激活并增殖,从而引发移植物抗宿主病(GVHD)并导致小鼠死亡。
另一方面,本次构建的人源化小鼠模型凭借血浆中维持在100-1000pg/mL范围的有限IL-4浓度,成功实现了人类B细胞的存活与增殖,显著延迟了GVHD的发生,并促进了抗体类别向IgG的转换。免疫球蛋白最初以IgM形式产生,在受到刺激后会在保持可变区不变的情况下,通过类别转换将恒定区转化为IgG或IgA。
此外,研究团队确认了移植后4周时B细胞的高定植率。移植后产生IgG的B细胞克隆数量增加,且随着时间的推移,IgG亚类的构成变化呈现出与人类相似的变化趋势。
研究还证实,产生的IgG克隆其可变区存在大量氨基酸替换,并发生了对抗原识别至关重要的体细胞超突变(SHM)。
在采用HER2(人表皮生长因子受体2)来源肽段(如CH401MAP与BAL6MAP)进行免疫的个体中,获得了多个能够对这些肽段产生反应的人源IgG克隆。研究团队同时还证实,还可以制备出用于大量生产单克隆抗体的人源B细胞杂交瘤。
此外,研究团队还在脾脏中观察到由人类B细胞和T细胞构成的三次淋巴组织样结构(TLS)。TLS被认为是在局部发挥免疫调控中枢作用的结构。尽管本次观察到的TLS尚不属于完全形态,但被认为可能支持免疫应答以及有限的免疫成熟。
利用本次开发的小鼠模型,可以评估患者等供体所携带的B细胞能够产生何种抗体。
研究团队表示,未来将致力于阐明支持人类B细胞长期存活的环境因子,同时开发更高效构建高特异性人源抗体生产杂交瘤的技术方法。
龟谷客座副教授表示:“在人源化小鼠模型中,NOG-hIL-4-Tg起初并未受到重视,但我们通过持续研究,逐步确立了其作为重建个体适应性免疫系统模型的价值,如今终于发表了具有说服力的研究成果。今后计划通过进一步改良,持续提升该模型的抗体产生能力。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Frontiers in Immunology
论文:IL-4 dependent enhancement of human IgG production in PBL-NOG-hIL-4-Tg mice
DOI:10.3389/fimmu.2025.1670682