和歌山县立医科大学医学部先端医学研究所的安艺大辅讲师(研究当时隶属于庆应义塾大学医学部)与庆应义塾大学、东京理科大学1月17日联合发表研究成果称,代谢功能障碍相关脂肪性肝炎(MASH)的肝脏炎症可通过调节性T细胞的增加而受到抑制。对MASH小鼠模型的分析表明,T细胞特异性核受体Nr4a家族的基因缺失会显著增加调节性T细胞,并增强抗炎功能。这一成果将有望推动MASH治疗方法的开发。相关研究成果已发表在国际学术期刊《The Journal of Clinical Investigation》上。
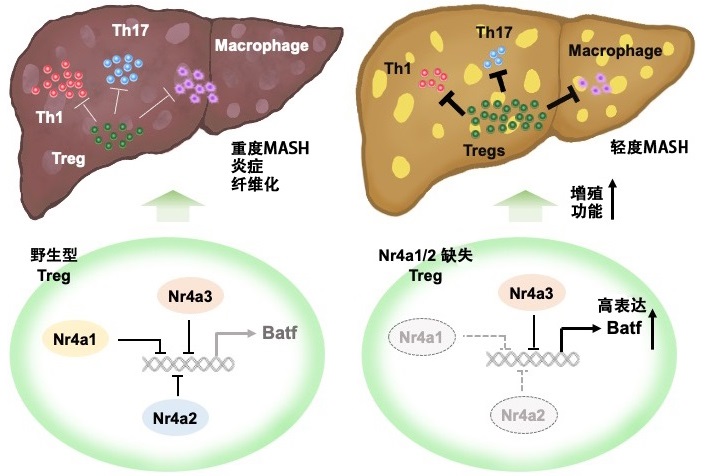
图1:研究成果概要(供图:和歌山县立医科大学)
MASH(Metabolic dysfunction-Associated Steatohepatitis)是由NASH(非酒精性脂肪性肝炎)更名而来的疾病名称。主要由非酒精性脂肪肝引起,病情进展可能导致慢性肝炎、肝硬化,甚至发展为肝癌。MASH在全球范围内呈增长趋势,在日本约有300万以上的患者,但目前尚无有效的治疗方法。
肝脏中除了主要负责肝功能的肝细胞外,还通过毛细血管含有包括T细胞在内的各种免疫细胞。随着肝炎的发展,细胞的死亡引发纤维化,进而激活免疫系统,形成进一步导致细胞死亡的恶性循环。因此,研究人员抑制怀疑免疫细胞与MASH之间存在关联,但具体机制一直未能明确。
此前,东京理科大学生命医科学研究所的吉村昭彦教授(研究当时隶属于庆应义塾大学)等人的研究表明,核受体Nr4a家族参与了T细胞向调节性T细胞(Treg)和CD8T细胞的分化,并在免疫应答中充当“刹车”角色。核受体与激素等细胞外物质结合后进入细胞核,并通过与特定基因序列结合来调控基因转录。
为了明确T细胞与MASH的关系,此次研究团队对通过特殊饮食诱导MASH的小鼠模型的肝脏T细胞Nr4a基因表达进行了解析。结果显示,在CD4T细胞和CD8T细胞中,MASH模型小鼠的Nr4a表达水平比野生型小鼠更高。
Nr4a家族由Nr4a1~3这三种非常相似的分子组成,T细胞中完全缺失这些分子的实验小鼠会因严重的自身免疫疾病而死亡。因此,研究团队采用了仅缺失Nr4a1和Nr4a2的dKO小鼠进行实验,并在其体内诱导了MASH。
其结果表明,在dKO小鼠中,MASH常见的肝功能下降、肝细胞死亡、炎症性巨噬细胞浸润及肝纤维化现象均有所缓解。此外,当仅在CD8T细胞中缺失Nr4a1/2时,并未观察到MASH的耐受性变化,因此推测CD4T细胞中的Nr4a对MASH的发病机制起关键作用。
为了进一步阐明机制,研究团队检测了肝脏中T细胞的分布情况,发现在诱导MASH的dKO小鼠肝脏中,促进炎症应答的Th1和Th17细胞减少,而抑制炎症反应的Treg则显著增加。
此外,研究团队还分离了野生型小鼠和dKO小鼠的CD4T细胞,并通过单细胞RNA测序进行了分析,结果显示,仅在dKO小鼠的肝脏CD4T细胞中,具有免疫抑制作用的IL10高表达,并且特定Treg亚群的数量及IL10的表达水平均有所增加。研究团队还证实,特定Treg亚群的转录因子Batf呈高表达状态,强制表达Nr4a2可抑制Batf的表达。进一步的实验表明,在dKO小鼠的Treg细胞中抑制Batf的表达会导致细胞增殖减少和IL10下降。
研究团队计划今后开发培养和增殖目标调节性T细胞的方法。
安艺讲师表示:“基于本次研究结果,我们有两个重要期待。首先,增加Treg数量可能对MASH的预防和治疗具有积极作用。其次,如果能够在T细胞中适度抑制Nr4a,或者相反提高Batf的表达水平,就有可能促进强效抗炎的Treg细胞扩增。结合这两种方法,有望开发出以T细胞为靶点的MASH治疗方案。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:The Journal of Clinical Investigation
论文:The Nr4a family regulates intrahepatic Treg proliferation and liver fibrosis in MASLD models
DOI:10.1172/JCI175305