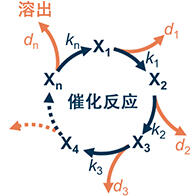
京都大学研究生院理学研究科的萩野浩一和前野悦辉两位教授创建了“原子核”周期表(图1)。
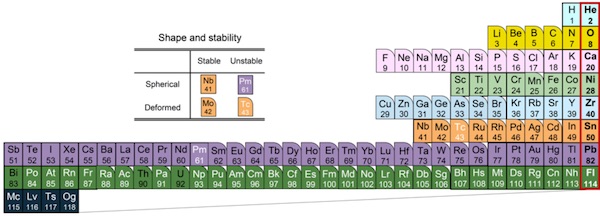
图1:新创建的原子核周期表
中学化学就学过,构成元素的原子的中心是原子核,电子围绕着原子核运动(图2)。原子核中含有的质子数为“原子序数”。“元素周期表” 的元素符号就是按原子序数的顺序排列的,性质相似的元素会排列在一起,这个排列体现了元素的周期性规律(图3)。2019年是德米特里·门捷列夫(Dmitri Mendeleev)创建元素周期表150周年(目前全球广泛使用的元素周期表其实并不是门捷列夫创建的“短周期表”,而是基于阿尔弗雷德·维尔纳(Alfred Werner)创建的“长周期表”)。
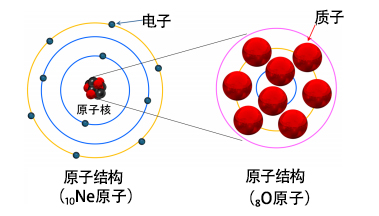
图2:原子与原子核的结构图。作为一例,图中所示为稀有气体元素氖(Ne)的 电子轨道以及原子核具有幻数的氧(O)的质子轨道,圆代表轨道的壳层。
原子核由质子(图中红色)和中子(图中黑色)构成。原子核带有与质子数成比例的正电。元素周期表体现了原子核周围运行的电子从低能轨道开始依次填满轨道壳层的情况。
在原子核中,可以认为构成原子核的质子和中子也有类似的运动轨道,原子核的中心并没有其他的“核”。不过,在质子和中子的相互作用下(汤川秀树提出的名为“核力”的强相互作用),原子核内部也会形成像电子一样分成几个壳层的轨道,并从低能轨道开始依次填满壳层。这被称为原子核壳层模型(Shell Model)。幻数的原子核是壳层正好被填满的原子核,对应稀有气体。不过,如图2所示,由于电子与质子和中子的环境(势能)不同,原子与原子核的各壳层所能容纳的最大数量大不相同。原子在电子数为2、10、18、36、54和86时,原子核在质子数为2、8、50、82和114时会填满轨道壳层,这时候性质变得稳定。另外,质子数为40时,虽然程度比较小,但也会显示同样的性质。中子也有同样的幻数,除114变成126外,其他与质子相同。
图3的不同颜色表示轨道的差异。最右一列的氦和氖等稀有气体,由于电子正好填满了轨道的外壳,因此性质非常稳定,是不容易发生化学反应的元素。
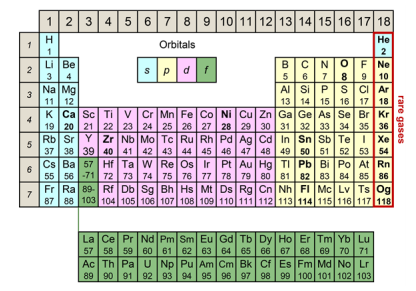
图3:元素周期表(维尔纳的长周期表)
那么,能否创建一个原子核周期表呢? 原子核中除质子外还含有中子,即使是相同质子数量的元素,也存在中子数不同的同位素。而且,中子数会大大影响原子核的稳定性。虽然有涵盖所有元素的核素图,但一直未发现其与元素周期表的对应关系。
对此,萩野浩一和前野悦辉教授通过选择各元素最具代表性的同位素,创建了图1所示与元素周期表对应的原子核周期表。该表右端排列的是与稀有气体元素相对应,质子数为幻数的元素。以前从未有人提出过这种原子核周期表。
图4仿照元素周期表(图3)用不同颜色对质子的轨道壳层进行了区分,原子幻数与原子核幻数的差异也变得一目了然。蓝色背景色表示呈圆形扩散的s轨道(图2的蓝色圆圈),直到第12号元素镁(Mg)其第三个3s轨道构成的壳层在电子中才被填满,而在质子轨道中则被第70号元素镱(Yb)填满,这样就反映出了电子轨道与质子轨道在性质上的显著差异。
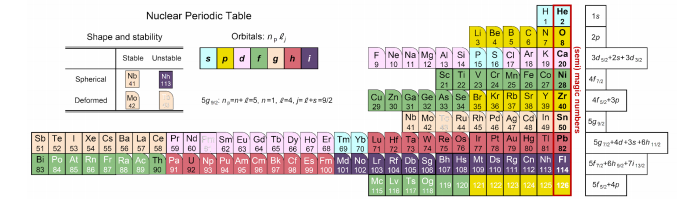
图4:用不同颜色对质子轨道进行了区分的原子核周期表
从该周期表来看,满足幻数的稳定原子核的形状接近球形。而离幻数越远,原子核形状就越接近橄榄球形,另外还出现了即使原子序数比铅(Pb)小也会自然衰变的不稳定原子核(白字元素)。在新的原子核周期表中,不仅是壳层结构,各元素的原子核变形和稳定性也一目了然。
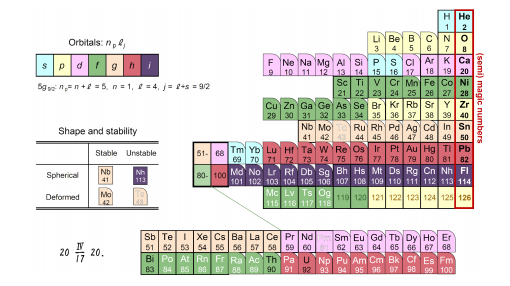
图5:形状与元素周期表(图3)类似的原子核周期表
图5的原子核周期表形状看上去与常用的元素周期表(图3)类似,但有一个很大的区别需要注意。在元素周期表中,正如属于同一列(族)的元素用相同的颜色表示一样,这些元素都拥有轨道性质相同的电子,因此在性质方面具有相似性。但在原子核周期表中,虽然上述幻数附近的性质具有周期性,不过从颜色差异上便可以看出,同一列元素的原子核拥有轨道不同的质子,因此在性质方面并无相似性。
这种能与元素周期表进行比较的原子核周期表,包括幻数在内,可以形成学习原子核性质的新指标。今后,大学的教科书等估计将采纳原子核周期表进行教学。
原子核周期表还可以做成立体的。将图1打印,用剪刀和透明胶带可轻松制作出下图(图6)中的模型。关于立体元素周期表,前野教授约20年前设计过“Elementouch”,并且还作为京都大学的商品销售,此次原子核立体周期表被命名为“Nucletouch”。

图6:原子核的立体周期表Nucletouch
论文信息
题目:A Nuclear Periodic Table
期刊:《Foundations of Chemistry》
DOI:https://doi.org/10.1007/s10698-020-09365-5
文:JST客观日本编辑部