东京工业大学科学技术创成研究院的原亨和教授和元素战略研究中心主任细野秀雄荣誉教授等人,成功开发出了在低于50℃的温度下让氢和氮合成氨的新催化剂。这种催化剂是钙结合了氢和氟的 “氢化氟化钙(CaFH)”与钌(Ru)纳米颗粒的复合材料“Ru/CaFH”,可以在室温下让氢和氮合成氨。
原教授等人着眼于CaFH在低温下提供电子的能力较强这一特点,开发成功了这款低温合成氨的催化剂。这种催化剂的诞生不仅能大幅提高氨的生产效率,还有望利用自然能源实现温室气体二氧化碳的零排放。
氨作为肥料为全球70%的人口提供了生命保障,是人类必须的化学物质。利用催化剂可通过氢和空气中的氮制造出氨来,不过,原料氢是利用甲烷等化石资源生产的,因此二氧化碳排放量占总排放量的3%以上。
但以往的催化剂,必须在近400℃的高温下才能使氢和氮合成氨。以往制氨过程中即使利用自然能源发电,大部分发电量也被用在了制氨上,无法生产足够的氢。开发能大幅降低用氢氮制氨的温度的催化剂,将为不排放二氧化碳的氨生产开辟道路。
背景
氨(NH3)是利用催化剂通过氢(H2)和空气中的氮(N2)制造出来的化学物质,作为肥料,为70%的人口提供了生命保障,是人类生产最多的化学物质,年产量达1.7亿吨。不过,氨虽然对人类非常重要,但随着地球变暖,其制造过程已经成为一个大问题。
问题出在从何处获得氢上。目前,氢是通过天然气、煤炭和石油等化石资源生产的。其结果是会产生大量的二氧化碳,超过总排放量的3%。只要人口持续增长,利用化石资源生产氨,所产生的二氧化碳排放量就会持续增加(图1)。
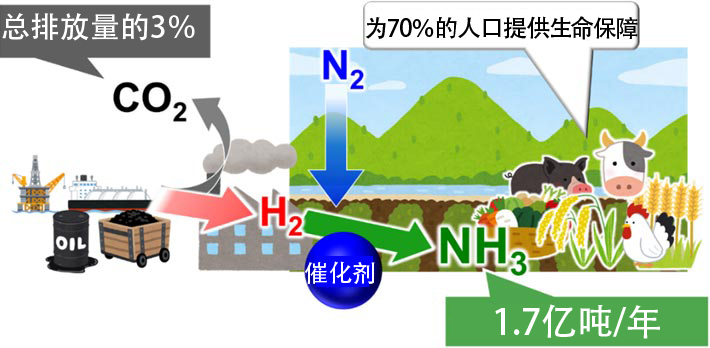
图1:氨与人类社会以及制氨存在的问题
作为在不排放二氧化碳的情况下生产氨的方法,人们一直在考虑利用自然能源发电(图2)。通过风力和光伏发电电解水的话,可以在不排放二氧化碳的情况下获得清洁的氢。以这样获得的氢为原料,人类就能在不排放二氧化碳的情况下获得氨,而且不必担心化石资源枯竭。
不过,这种方法存在一个大问题,即通过氢和氮合成氨的现有催化剂需要400℃左右的高温。利用电力产生高温时需要消耗大量能源,这样来自自然能源发电量中有一大半都被用于产生高温以便让氢和氮合成氨,能用来电解水生产氢的电力将变得不足。要想实现利用自然能源生产氨的计划,就需要大幅降低氢和氮合成氨的温度。
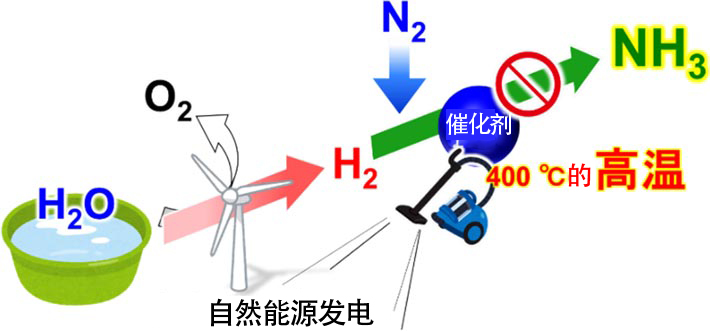
图2:使用自然能源的氨生产
研究成果
1. 新方法
在此背景下,原教授等人构思了氨合成催化剂在非常低的温度下工作的新方法。图3是氨合成催化剂的温度与氨合成速度之间的关系。正如砂糖在热水中的融化速度比在冷水中快一样,氨合成速度也会随着温度的升高而加快。此前一直认为,在高温下发挥高性能的催化剂在低温下也会发挥相应的高性能。但原教授等人的研究显示,此前开发的所有催化剂在100~200℃的温度下就会变得完全失效。
也就是说,利用以往的方法开发出工作起点温度为100~200℃的催化剂,斜率大的催化剂被视为高性能催化剂(图3红线部分)。虽然这些催化剂在高温下的合成速度会加快,但低温下的合成速度则基本为零,所以使用时无法大幅降低温度。
人们一直在尝试将催化剂的工作温度降至50℃以下,也就是把温度-氨合成速度曲线移至低温侧的方法(图3蓝线)。这样低温区域的氨合成速度会显著提高,但此前并没有成功过。
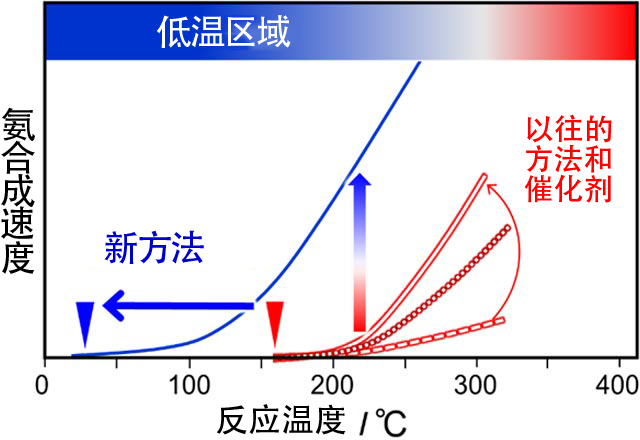
图3:氨合成速度-反应温度曲线
2. 新电子供体材料CaFH
原教授等人首先着手开发了在低温下也能强力提供电子的材料(电子供体材料)。氨合成中的最大困难是氮分子N2分解成氮原子的过程。氮分子是由两个通过强键结合氮原子组成的稳定分子。要想将氮分子分解成原子,需要通过铁等过渡金属暂时向氮分子提供电子(图4)。
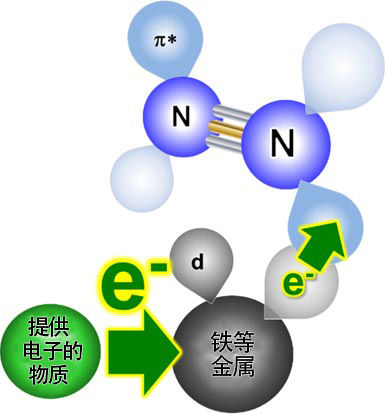
图4:通过向金属提供电子加速分解氮分子
因此,原教授等人着眼于常见的脱水材料“氢化钙CaH2”(图5)。CaH2是Ca2+的阳离子与氢的阴离子H–(氢化物离子)结合的离子性固体,温度加热到200℃以上后,部分H–会以氢分子的形式逸出,将电子留在Ca2+离子周围(2H–→H2↑+ 2e–)。这种状态下的电子具有与碱金属相当的电子提供能力(较大的离子化倾向),因此通过该电子提高过渡金属的电子提供能力的话,N2分子可以分解成氮原子。不过,由于Ca2+—H–的离子结合能较强,无法在低温下使用。
于是,原教授等人决定加入能与Ca2+形成更强结合的阴离子,削弱Ca2+—H–的结合能。Ca2+—F–的结合能是Ca2+—H–的2倍,因此如果将CaH2的部分氢化物离子置换为F–,形成氢化氟化钙CaFH,那么这种氢化物离子在低温下应该会以氢分子的形式解离,从而在低温下发挥较强的电子提供能力(图5)。在实际合成的CaFH中确认,氢化物离子从室温上下的温度开始以氢分子形式逸出。
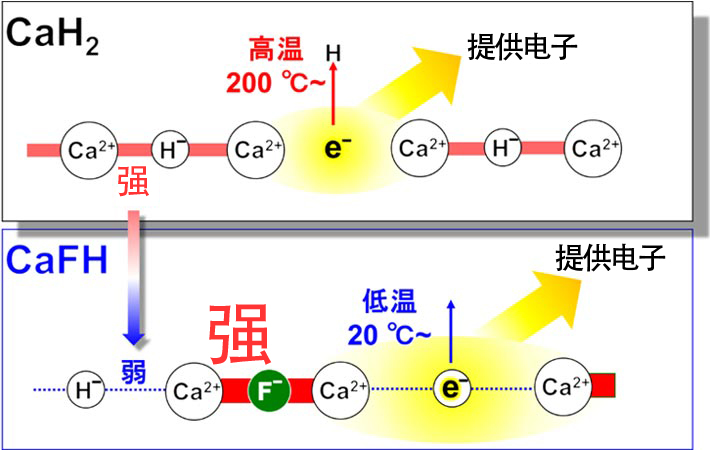
图5:CaH2和CaFH的结合强度、析氢温度及电子提供
3. 钌纳米颗粒-CaFH复合材料催化剂(Ru/CaFH)的氨合成能力
图6是钌(Ru)纳米颗粒-CaFH复合材料催化剂(Ru/CaFH)的电子显微镜照片。这种催化剂是在CaFH的基底(灰色)接合了直径为数纳米的Ru纳米颗粒(白色)的固体材料。观察发现,该催化剂在低于100℃的温度下也能合成氨,甚至在50℃时也会发挥作用(表1)。这表明,在低于50℃的温度下也能合成氨。实际上,已利用光谱法确认,这种催化剂在室温下也能通过氮分子合成氨。而目前制氨使用的铁催化剂,以及最近刚刚发布的最高性能催化剂和排名第二位的催化剂在低于100℃的温度下时则完全无法工作。在100℃以下的温度下与Ru/CaFH进行比较对其他催化剂不公平,因此表2显示了200℃下的结果。200℃时Ru/CaFH的性能为最高性能催化剂的2倍以上,即便在高温下也超过了现有催化剂。

图6:Ru/CaFH的电子显微镜照片
另外,Ru/CaFH的活化能为20kJmol-1(表1),只有目前氨合成催化剂的1/2左右。另外,Ru/CaFH是稳定的催化剂,即使在300℃以上的反应温度下,也能连续工作900多个小时而不降低氨合成速度。
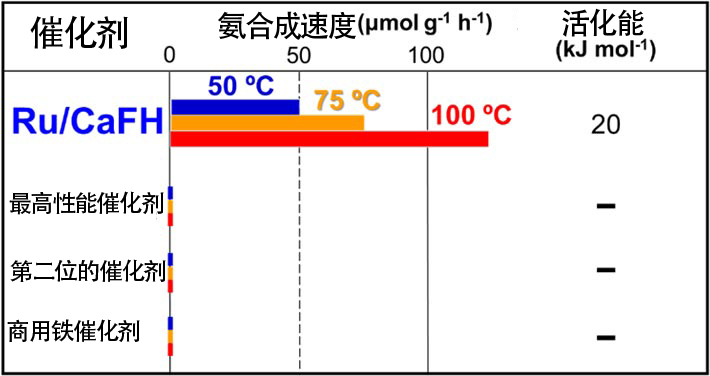
表1:Ru/CaFH的催化剂性能(100℃以下)
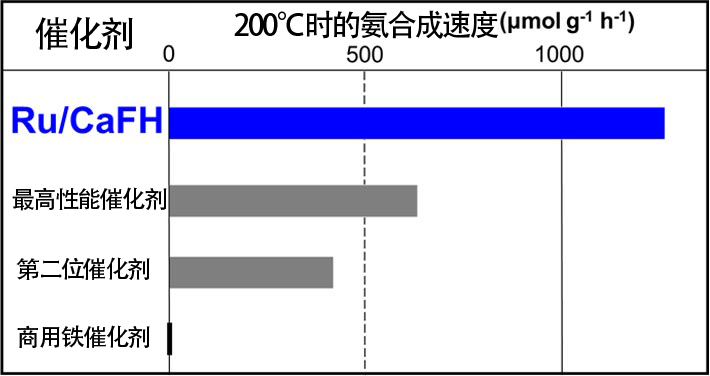
表2:Ru/CaFH的催化剂性能(200℃)
4. Ru/CaFH的催化机理
图7是通过各种解析明确的Ru/CaFH的催化机理。首先在室温前后,氢原子从CaFH中逸出,留下电子。在此状态下,CaFH具有与金属钾相同的强电子提供能力,会向Ru强力提供电子(图7下)。氮分子N2与该状态下的Ru接触后,N2立即分解为N原子。在Ru表面,氢分子H2分解生成H原子,因此氮原子与氢原子直接反应,生成氨NH3。研究确认,这个过程在室温下也能进行。
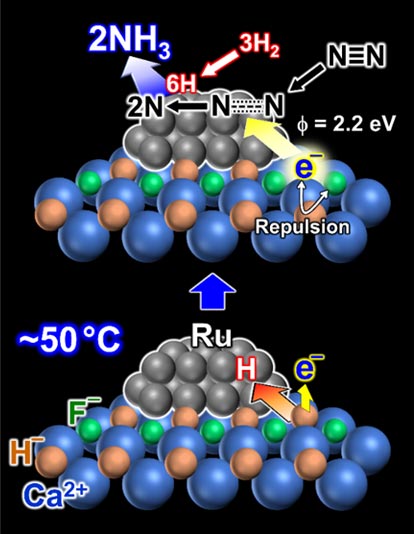
图7:Ru/CaFH的催化机理
未来展望
此次开发的Ru/CaFH有两个意义。
第一,通过降低催化剂最低工作温度的新方法及开发使该方法成为现实的新催化剂材料,氨合成催化剂的性能在300℃以下的低温区域显著提高。
第二,实现了在低于100℃的温度下也能工作的催化剂。以往的催化剂在100℃以下会失效。因此,无论怎样改良,也无法在低于100℃的温度下合成氨,而Ru/CaFH能在室温下合成氨。正如以往的催化剂通过以往的方法提高了性能一样,Ru/CaFH或者以其为基础的催化剂性能有非常大的提高空间。
论文信息
论文题目:Solid solution for catalytic ammonia synthesis from nitrogen and hydrogen gases at 50℃
发表期刊:Nature Communications
DOI:10.1038/s41467-020-15868-8
文:JST客观日本编辑部