接上篇 【人物】跨越生物化学和细胞生物学的科学家——水岛升(上)
探索神秘而复杂的生命世界
现代社会,人类可以享受比较丰盛的饮食,但生物的历史也是一场与饥饿的斗争史。有一个广为流传的说法,我们只要有水,就可以生存一个星期。这和一种叫做自噬的机制有关,该机制将我们自身细胞组织中的蛋白质分解成我们需要的氨基酸,而氨基酸是生物体的生命所必需的。据估计,成年人的人体每天产生200-300克蛋白质,其中包括从饮食中摄取约60-80克蛋白质。饮食摄入量和身体产生的蛋白质之间的差异(后者大约是前者的2.5倍)来自哪里?这个过程中的一个关键因素正是自噬。自噬将细胞中的蛋白质分解成氨基酸,然后再次用于制造新的蛋白质和获取能量。为了试图理解支撑生命现象的能量和物质的无形流动,换句话说,为了以可见的方式了解新陈代谢,就需要挑战去 “观测”这些分子。通过捕捉细胞生存方式的动态方法来了解为什么会有自噬的现象发生。
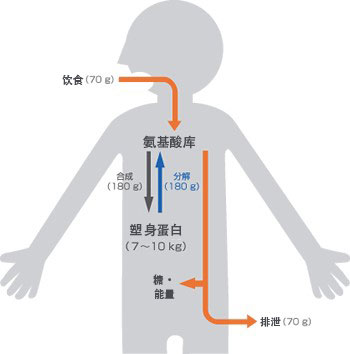
图2 成人每天的蛋白质代谢情况
自噬现象在上世纪60年代仅通过电子显微镜确定,但其生理意义和所涉及的分子群长期以来一直不为人所知。然而,在上世纪80年代末,大隅良典教授和他的同事证实,芽殖酵母也有自噬功能,研究进展迅速。 酵母的遗传分析已经很先进,迄今已发现近20个自噬相关基因。 有趣的是,它们中的大多数也存在于高等植物和动物中,包括哺乳动物。 对这些基因产生的蛋白质进行分析,发现了一组定位在参与自噬的膜上的蛋白质,如封存膜和自噬体。水岛等人在生物实验过程中重视观察,但是有时候先入为主的观念反而会阻碍发现真相,所以他们在观察时不抱有先入为主的想法,而是首先集中精力研究比较对象之间的差异,并且慎重地读取其中的信息。
当时水岛的研究既关注自噬的分子机制,也关注自噬在体内的作用,双管齐下进行深入研究。为了便于观察,他们使用了绿色荧光蛋白(Green Fluorescent Protein, GFP),这是一种约29kDa的蛋白质,吸收蓝光并发出绿色荧光(这种蛋白质是2008年诺贝尔化学奖得主 下村修教授 在1962年发现的)。绿色荧光蛋白附着在这些蛋白分子上,用荧光显微镜成功地观察到其培养细胞体内的自噬现象。将细胞转移到无营养的培养基中使其处于饥饿状态,在短短半小时或一小时内,就可以观察到自噬现象发生,一个细胞内大概有100或200个自噬体。
为了进一步做研究,水岛之后在小鼠身上做了与培养细胞完全相同的实验。他制作了转基因小鼠,同样用绿色荧光蛋白使自噬细胞发光。这样一来就可以一目了然地观察到自噬发生在身体的什么地方,以及什么时候发生。在利用小鼠的试验中发现,其幼崽从出生后到被喂食为止,细胞处于饥饿状态。为了维持身体所需的氨基酸浓度,会发生自噬。如果小鼠不能自噬,它们会在出生后半天内死亡。此外,哺乳动物的卵子受精并在体内着床也需要大约一个星期。在这段时间里,卵子必须在没有任何外部营养支持的情况下继续发育,自噬也参与了这个过程。储存在卵子的蛋白质被分解,氨基酸被再利用。也就是说,对于细胞来说选择是非常简单明快的事:如果没有来自外部的营养,它们决定从自己的细胞内部获取营养。另外还有一件趣事,水岛制作的转基因小鼠非常受欢迎,据悉已被分发给世界各地的500多个实验室,涵盖了除了南极洲以外的四大洲的实验室,堪称“征服四大洲”。
细胞是由生物大分子组成的,如脂质和碳水化合物,但其中最丰富和最重要的是蛋白质。此外,细胞还包含一些细胞器,如含有DNA的细胞核、产生能量的线粒体和负责分泌蛋白质的内质网。这些蛋白质和细胞器会随着时间的推移而变老,还有些蛋白质甚至在合成过程中失败,就像垃圾一样散落在在细胞中。如果不清理这些垃圾,细胞就会变得肮脏。在实验过程中,通过观察无法在其神经组织中进行自噬的小鼠,发现异常蛋白质在神经组织中的积累可导致疾病。
细胞的自我清洁的能力则被称为自噬。当细胞器和不再在细胞中发挥作用的蛋白质积累时,在细胞中就会形成一种叫做“封存膜”的膜。 这些膜延伸并包裹着碎片,形成一个球形的形状,称为自噬体。 然后自噬体与溶酶体融合,后者含有分解细胞器、蛋白质和其他物质的酶,以清理细胞。 里面的细胞器和蛋白质被分解并作为细胞内的营养物质重新使用。
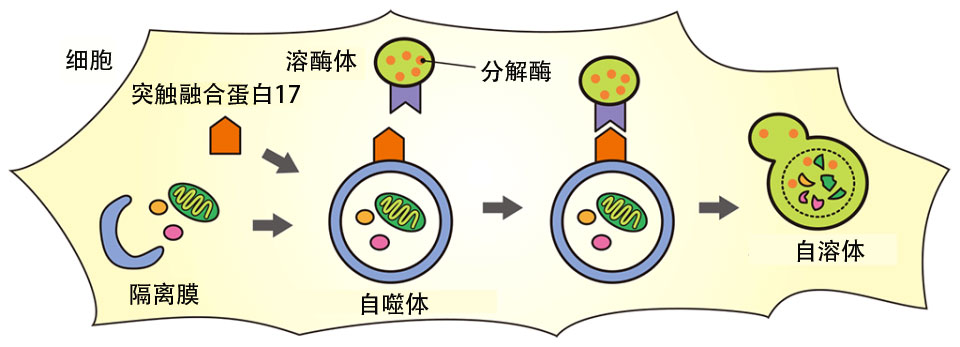
图3 自噬如何分解细胞内的物质
出典: lne.st/2016/01/28/mizushima-noboru/
唯有热爱,才能坚持研究
溶酶体将降解酶带到自噬体。 当它们附着在自噬体上时,它们寻找的是什么? 事实证明,溶酶体不会附着在那些正在吞咽垃圾、尚未闭口的溶酶体上,而只会附着在已经闭口、成为完美球体的自噬体上。2012年,水岛升发现溶酶体如何识别自噬体。 显然,一种叫做突触融合蛋白(Syntaxin)17的蛋白质可以作为一个标记。 当自噬体球体完成后,突触融合蛋白17被转移到自噬体的膜上。 现在已经知道溶酶体可能会识别这一点。突触融合蛋白17通常存在于细胞膜和其他细胞器中,但人们认为它在自噬体形成后立即被转移到自噬体中。那么,突触融合蛋白17如何知道自噬体已经完成--封存膜上的洞已经关闭,细胞已经变成球形的呢?这正是水岛所关注的问题。
在2013年,首个具有自噬基因异常的人类疾病被发现了。 这种名为“SENDA”的疾病从出生开始就会导致智力运动障碍,直到20岁左右症状不会有太大的变化,到了30岁左右会突然恶化为类似帕金森病的症状,导致患者卧床不起。 水岛在与横滨市立大学的才津智准教授和松本直通教授以及群马大学的村松一洋助教(当时的职称)等人合作进行的研究发现,该疾病与自噬的一个基因异常有关联。 当他们从这些细胞中抽取血细胞时,发现它们的自噬活性降低了。 这是人类的首例自噬基因疾病。根据海外的研究团队的研究,发现细胞中被替换的不仅仅是蛋白质,还有线粒体,它是细胞中的细胞器。线粒体通常会释放活性氧(ROS),有一点点活性氧是好的,但如果它们开始释放大量的活性氧,就会变得危险,所以危险的、受损的线粒体需要从细胞中消失。事实证明,自噬也在其中发挥了作用。需要注意的是,线粒体自噬所需的基因是Parkin和PINK1,而这两个基因是家族性帕金森病的致病基因。因此,研究者认为Parkin和PINK1的突变可能使这些危险的线粒体不受控制,对神经元和其他细胞造成损害。 这种机制可能是造成帕金森病的部分原因,并且拥有大量产生活性氧的线粒体不仅对神经细胞死亡很重要,而且对癌症的发病等也很重要。

水岛升教授(照片出自东大新闻在线网,摄影:一柳里树)
现在大家已经知道帕金森病、阿尔茨海默病和其他与大脑有关的疾病也是由神经细胞中的异常蛋白质堆积引起的,所以从理论上来说,自噬也可能会防止这些疾病的发生。对饥饿的反应是生物体内一个非常基本的机制,但直到二十多年前,在很大程度上并不为人知。 自噬本身在大约六十多年前就已被发现,但在大隅教授发现相关基因和能使自噬体发光的蛋白质之前,几乎没有办法研究这一机制。在随后的十多年年里,许多事情被逐渐阐明。水岛得以在2004年发现Atg缺陷的小鼠,在2006年发现异常蛋白的降解和纯化,在2008年发现在受精中的作用,都离不开众多研究者们努力探索出来的研究成果。当被问及对研究的看法时,水岛说:“自从我是一名医科学生以来,我一直对在整个身体内发挥作用的东西(例如新陈代谢)感兴趣,而不是对某个特定的器官。当时我在医学院学习到酶和其他物质在体内进行生物合成,但没有人能阐明这些材料来自哪里,为什么合成的产品最后会消失。因为抱有兴趣却毫无头绪而言,所以我选择了直接进入临床工作,研究免疫学。我重视基础研究。虽然在研究中发现的一些东西可能对治疗疾病有用,但我做这项研究的主要动机是为了更好地了解生物。”
正是因为有千千万万像水岛一样的科学家,怀着对生物的探索之心,通过了解神秘而复杂的生命世界,人类最终才有可能治愈疾病。在此预祝水岛教授带领的研究团队在今后的工作中取得更大的成就。
供稿:马佳宥
编辑修改:JST客观日本编辑部
【参考资料】
东京大学研究生院医学系研究科分子生物学领域水岛研究室
武藏高等学校中学校——毕业生畅谈学习的土壤:水岛升专访
公益财团法人TERUMO生命科学振兴财团——生命科学DOKIDOKI研究室:水岛升专访
东京大学教授水岛升 / 什么是自噬(细胞吞噬作用)?
JST新闻2014年1月号 揭开隐藏在生命中的分解的秘密
东大新闻在线——水岛升教授访谈













