以日本分子科学研究所的西田纯助教、熊谷崇副教授为首的研究团队发布研究成果称,利用红外近场显微光谱法(限制在纳米级空间中的光)观察到了单一蛋白质,并成功测量了有用的红外振动光谱用于化学分析。相关成果已刊登在《Nano Letters》在线版上。
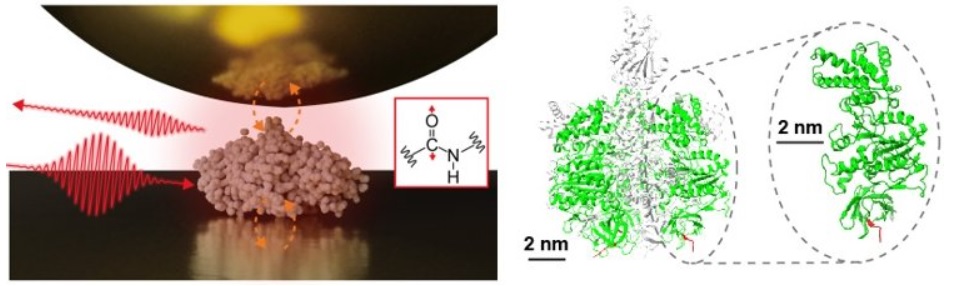
图1 (左)测量单一蛋白质的红外近场显微光谱示意图。(右)蛋白质复合体F1-ATPase和此次测量的亚基结构。(供图:分子科学研究所西田纯助教)
由于使用红外光可测量被称为分子指纹的振动光谱,因此被广泛应用于化学分析。近年来,随着纳米技术的快速发展,利用红外光进行超高灵敏度和超高分辨率成像的需求不断增加。然而,使用普通红外光的显微光谱无法实现极微量样品的测量和纳米级空间分辨率。因此,即使使用通常被认为具有高灵敏度的红外显微光谱装置,测量红外光谱通常也需要100万个以上的蛋白质,仅测量一个蛋白质是不可能的。
此次,研究团队在金属基板上分离了包含于蛋白质复合体F1-ATPase的亚基(单一蛋白质),并在大气环境中进行了红外近场显微光谱的测量。结果,证明可以获得单一蛋白质的红外振动光谱。单一蛋白质的测量是阐明蛋白质复合体和膜蛋白等的高级功能的重要技术。此外,还构建了描述纳米空间中高度局域化的红外近场与蛋白质之间相互作用的理论框架,并成功定量再现了所获得的信号。
相关成果有望应用于使用红外光的超高灵敏度和超高分辨率成像的技术革新,以及包括生物分子的化学分析在内的各种纳米材料中的应用。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Nano Letters
论文:Sub-tip-radius near-field interactions in nano-FTIR vibrational spectroscopy on single proteins
DOI:doi.org/10.1021/acs.nanolett.3c03479