日本大阪大学产业科学研究所的Martijn Zwama特任副教授(常勤)、西野邦彦教授、药学部六年级学生樱井希望、美国圣路易斯华盛顿大学的Yan Yu教授及美国印第安纳大学布卢明顿分校的Swagata Bhattacharyya等人,通过运用新开发的两亲性雅努斯纳米颗粒(Janus nanoparticles),成功恢复了多重耐药革兰阴性菌对抗菌药物的药物敏感性。该成果有望为解决全球性难题——耐药菌问题提供突破口。相关研究成果已发表在《Nano Letters》上。
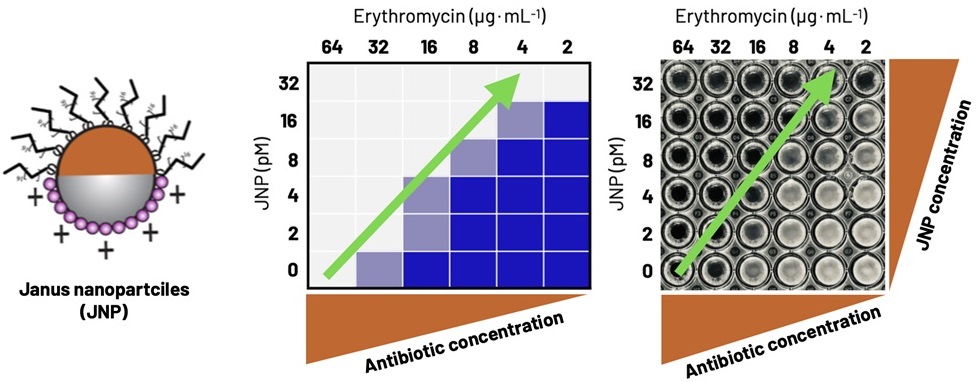
图1. 左侧为具有非对称结构的雅努斯纳米颗粒(JNP)。中央和右侧是分别以示意图(蓝色=存活细胞)和实拍照片(白浊区域=存活细胞)形式显示的细菌增殖情况,对比了从高到低不同梯度的抗菌药浓度与JNP浓度组合条件。在不添加JNP的情况下,细菌需在64 µg/mL的抗菌药浓度下才会被杀死,而添加JNP后,所需的抗菌药浓度则大幅降低。且JNP浓度越高,杀死细菌所需的抗菌药浓度就越低(如绿色箭头所示)。(供图:Martijn Zwama特任副教授,大阪大学)
全球范围内,对抗生素产生耐药性的细菌感染病例数量正在不断增加,以鲍曼不动杆菌(Acinetobacter baumannii)和大肠杆菌为代表的革兰氏阴性菌(Gram-negative bacteria),因其拥有坚固的外膜和多药外排系统,导致药物难以起效,已成为极其严重的威胁。这些细菌中的多数已对多种抗生素表现出耐药性,部分菌株甚至对目前临床上几乎所有可用药物都获得了耐药性。由于耐药性是由抗生素靶点的突变、抗菌药物的分解与修饰、膜通透性的改变以及主动将药物排出细胞外的外排泵过度表达等机制导致,因此,以往常用抗菌药物的疗效正迅速减弱。
为了维持现有抗菌药物的有效性,亟需开发能够与抗菌药物联用,恢复其对耐药菌杀菌效果的新型佐剂。
研究团队开发了一种由疏水性半球和多价阳离子性半球构成、具有独特双面性(两亲性)结构的雅努斯纳米颗粒。该设计旨在通过与细菌膜相互作用以削弱其结构,从而增强多种抗菌药物类别的活性。
雅努斯纳米颗粒能够附着在革兰氏阴性菌的细胞膜上,使其膜结构发生变形,从而增强联合使用的抗菌药物的摄取和活性。在极低浓度下,雅努斯纳米颗粒本身并不能单独杀死细菌,但与抗菌药物联用时会产生协同效果。
具体而言,研究团队确认了雅努斯纳米颗粒与多种抗菌药物之间存在强协同效应,这些药物包括红霉素、新生霉素、利福平、卡那霉素、溴化乙锭和氯唑西林等。根据抗菌药物种类的不同,在多种细菌中对必要抗菌药物浓度的降低效果可达100倍以上。此外,由于具有对称结构的纳米粒子并未表现出类似的协同效应,这表明雅努斯纳米颗粒的非对称性是实现抗菌药物功能的关键。
此外,研究团队还全新开发了一种可嵌入琼脂凝胶的雅努斯纳米颗粒系统。该系统能确保与具有运动性的大肠杆菌等细菌有效接触,即使像β-内酰胺类等起效较慢的抗菌药物也能实现持续的增效作用。该成果为抗菌涂层、创伤敷料等临床应用领域提供了新的可能性。
本研究提出了一种不依赖于遗传学和生物化学靶向、基于材料化学的新型抗菌药物增效策略。由于雅努斯纳米颗粒通过与细菌膜进行物理相互作用来发挥功能,因此细菌难以对其产生耐药性,并能与多种现有抗菌药物产生协同效应,将其作为佐剂联合使用,可有效延长现有药物的临床使用寿命。此外,嵌入雅努斯纳米颗粒的琼脂凝胶有望拓展至抗菌涂层、药物递送系统等新领域,为抑制多重耐药菌感染开辟了创新的临床应用前景。
西野教授表示:“本研究是在材料化学与微生物学融合的国际联合研究推动下,实证了单一学科领域无法达成的新型创新成果。多重耐药菌感染在全球范围内日益严峻,已成为医疗现场的紧迫难题。本次研究所展示的两亲性雅努斯型纳米颗粒,是一种能够恢复现有抗生素疗效的新策略,且因其不易引发耐药性,我们相信这是一项具有重大社会影响力的技术。期待该成果能为今后的耐药菌防控提供新的助力。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nano Letters
论文:Amphiphilic Janus Nanoparticles Synergize with Antibiotics to Restore Susceptibility in Drug-Resistant Gram-Negative Bacteria
DOI:10.1021/acs.nanolett.5c05337