大阪大学微生物病研究所的平冈毅大特任助教(研究当时,现为东京大学注册研究员)与伊川正人教授等人的研究团队宣布,成功开发出了小鼠体外子宫系统,并实现了着床过程的再现。该系统可在体外维持生物体内的子宫着床环境,高度再现了胚胎黏附、浸润、胚胎发育等着床过程。通过使用该系统,有望在体外研究着床过程,为提高着床率等技术的开发做出贡献。相关成果已发表在期刊《Nature Communications》的7月1日刊上。

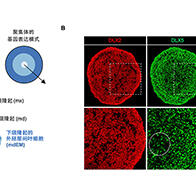
图1.体外子宫上的着床与发育(供图:大阪大学)
壁侧滋养外胚层的黏附及此后的胚胎发育(上);在维持着床的状态下,可观察到上胚层样结构与胚外外胚层样结构的形成(下)。
在日本,人类生殖辅助医疗(ART)的需求逐年增加,约每10人中就有1人通过ART出生。其中,通过体外受精或显微授精技术有望实现80%以上的受精成功率,但着床方面的成功率为50%以下,且随年龄增长而下降,已成为ART成功率的瓶颈。对于反复移植优质胚胎仍无法着床的反复着床失败,目前尚无有效的治疗方法。
另一方面,着床是在子宫深部,由多个分化细胞团构成的囊胚和多种细胞类型组成的子宫内膜相互作用而完成的复杂生命现象,即便使用实验动物,研究本身也颇具难度。
囊胚(成熟的受精卵)首先会黏附于子宫内膜,经过名为“浸润”的侵入子宫内膜的过程后继续胚胎发育。此前虽有过利用模拟囊胚或子宫类器官开展的研究,但未能再现实际的着床过程。
此次,研究团队旨在制作一种在体外再现更接近生物体内着床过程的新型实验模型。
东京大学广田泰教授等人的先行研究已在小鼠中发现,子宫内膜的多种因子对于着床而言是必需的。
因此,研究团队探讨了构建一种将实际子宫组织的体外培养与胚胎培养相结合的系统。
具体而言,研究团队从小鼠中获取了即将着床期的囊胚,确立了仅将另一只小鼠的子宫内膜分离到薄片上的技术,将子宫内膜切成切片状后,与囊胚共同培养。培养采用了可供应培养液的气液两相培养法。同时,通过新选用具有氧气透过性的材料PDMS(聚二甲基硅氧烷),设计了可实现氧气供给的培养系统。
研究人员在培养皿的培养液中设置的琼脂培养基上放置子宫内膜片,其上放置囊胚,上方用较厚的片状PDMS覆盖。由此构建了一个可将囊胚保持在子宫内膜片上,在琼脂上培养子宫内膜片的同时,通过PDMS供给氧气的系统。
此外,研究团队还对培养液的组成、器件尺寸等多种条件进行了探讨与优化。
结果显示,该系统能以90%以上的概率诱导子宫内膜与囊胚的黏附。交配后24小时后囊胚出现黏附,96小时后在维持着床状态的同时可观察到胚胎发育。
着床后的囊胚形成了属于胎儿成分的上胚层以及将来会发育为胎盘的胚外外胚层,并出现了脏内胚层、壁内胚层、卵黄囊腔。同时成功观察到了胚胎细胞经分化后逐渐侵入子宫内膜细胞的情况。
为进一步确认子宫侧是否成功再现了这些现象,研究人员对子宫内膜进行了单细胞RNA测序。
结果表明,在子宫内膜中也观察到了生物体内表达的基因表达。研究人员随后通过免疫染色证实,在子宫内膜片内存在生物体内着床时可观察到的三维结构——子宫腺管结构,并且再现了与免疫耐受相关、对着床至关重要的血细胞等因子。囊胚着床时产生的、为血管新生而出现的暂时性无血管状态也得到了再现。
利用该系统,研究人员验证了能否对迄今为止尚不明确的、子宫中着床因子COX-2(一种合成前列腺素的酶)控制着床过程的机制进行解析。
结果证实,与生物体相同,通过抑制子宫侧的着床因子COX-2的功能,着床会受到阻碍,而通过补充该因子,着床即可恢复。此外还新发现,COX-2会通过下游信号激活胚胎滋养膜细胞的AKT分子。
目前,96小时后的发育过程无法再现,此后的发育被认为可能有系统未包含的其他因子参与。
平冈研究员表示:“今后通过在体外再现多种着床失败的病理状态并进行验证,有望能够发现着床失败的治疗方法。同时,也期待该研究能够提高ART中的着床成功率。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Communications
论文:An ex vivo uterine system captures implantation, embryogenesis, and trophoblast invasion via maternal-embryonic signaling
URL:https://www.nature.com/articles/s41467-025-60610-x