东京大学等研究团队发现,通过向在癌症放射线治疗中被认为实用性较低的对映异构体硼化合物添加液体胶成分,较现行临床中使用的药物更容易聚集并停留在癌细胞中。研究团队利用加速器硼中子俘获疗法(BNCT)成功使小鼠体内的癌症基本消失。今后,研究团队计划将其应用于人类的胰腺癌等难治性癌症上。
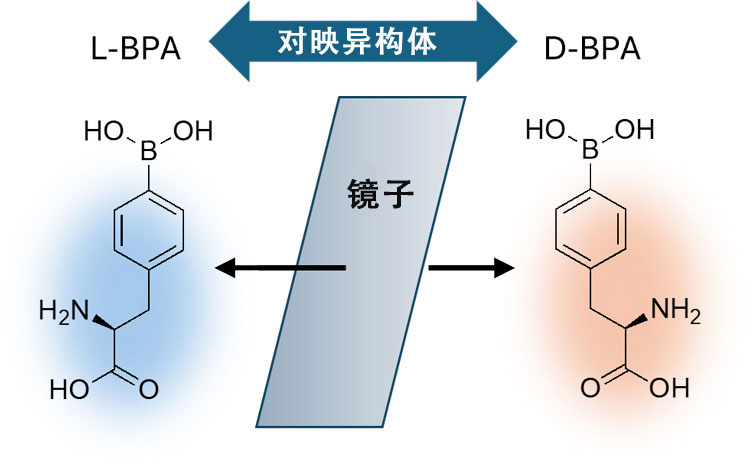
加速器硼中子俘获疗法 (BNCT) 中使用的L-L-硼酰基苯丙氨酸(L-BPA,左)的对映异构体D-BPA(D-BPA,右)和聚乙烯醇(PVA)结合后,药物更容易聚集和停留在癌细胞中(供图:东京大学野本贵大副教授)
BNCT是通过低能量热中子与硼原子碰撞,在约一个细胞大小的范围内产生辐射来杀死癌细胞的放射治疗方法。该疗法已在2020年被批准适用于某些无法手术切除的头颈部癌症。目前,基于其较强的癌细胞吸收性,临床上主要使用L-硼酰基苯丙氨酸(L-BPA)作为药物。
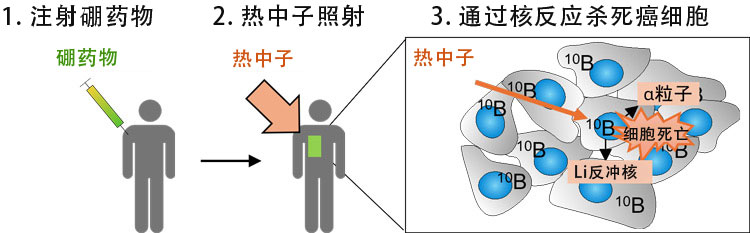
BNCT原理概述。通过注射硼苯丙氨酸(BPA)并用加速器等产生的热中子照射来杀死含有BPA的细胞(供图:东京大学野本贵大副教授)
L-BPA可通过被癌细胞特有的转运体特异性地吸收达到临床所需的浓度,并在热中子照射下杀死癌细胞。然而,该方法也存在一些限制其效果的问题,例如被吸收后如果时间过长,会通过转运体释放到细胞外,或通过其他的转运体进入正常细胞等。
研究将药物输送到体内特定部位的药物靶向递送技术的东京大学研究生院综合文化研究科的野本贵大副教授提出了“是否能让L-BPA更有选择性地被癌细胞吸收,并长时间停留在细胞内?”的想法。2020年研究团队通过在L-BPA中加入一种在液体胶中使用的聚乙烯醇(PVA)后,发现可以促使癌细胞通过膜内凹形成的囊泡更加容易地吸收药物。研究团队推测,将难以被癌细胞吸收且此前认为对癌症治疗无用、与L-BPA结构上如左右手般对称的对映异构体D-BPA,如果能与PVA结合使用,可能对癌症治疗同样有效,为此开始了相关实验。
研究发现,当将D-BPA与PVA共同作用于小鼠大肠癌及来源于人类胰腺癌的培养细胞时,与L-BPA一样,D-BPA通过囊泡更容易被癌细胞吸收。此外,通过动物实验观察药物在癌细胞中的浓度发现,与L-BPA相比,D-BPA在癌细胞中可以维持较高浓度更长时间。野本副教授分析原因表示,这可能是因为D-BPA不像L-BPA那样会通过运输体从细胞内流出的缘故。
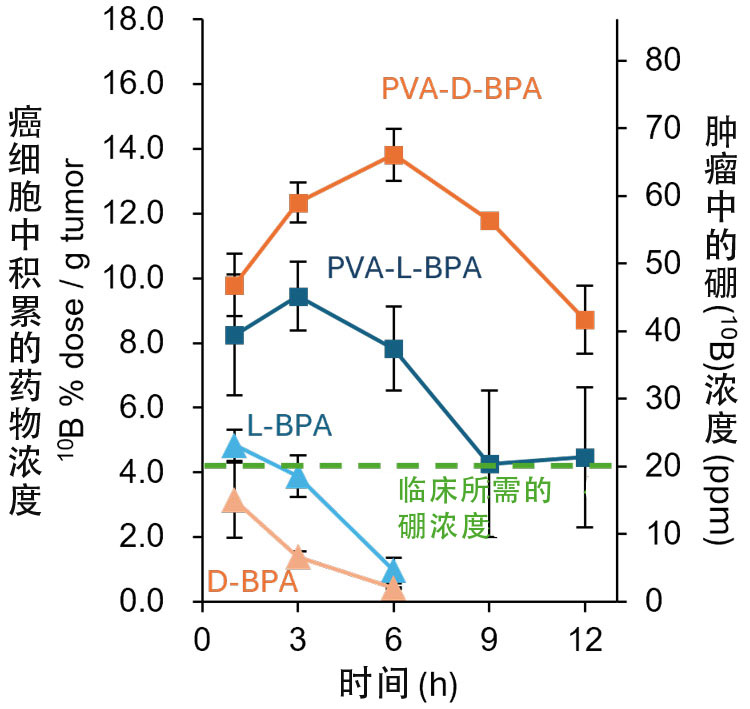
向患有皮下癌的小鼠静脉注射药物后,对药物在癌细胞上的吸收情况进行了检测。L-BPA和D-BPA与PVA结合时药物在癌症部位的积聚均有明显增加,其中PVA与D-BPA组合的药物表现出更高的浓度和更长的积聚时间(供图:东京大学野本贵大副教授)
在使用硼中子俘获疗法(BNCT)对小鼠进行实验时,与目前临床使用的未加入PVA的L-BPA相比,加入PVA的D-BPA能够显著减少癌细胞体积,甚至达到几乎全部消除的水平。
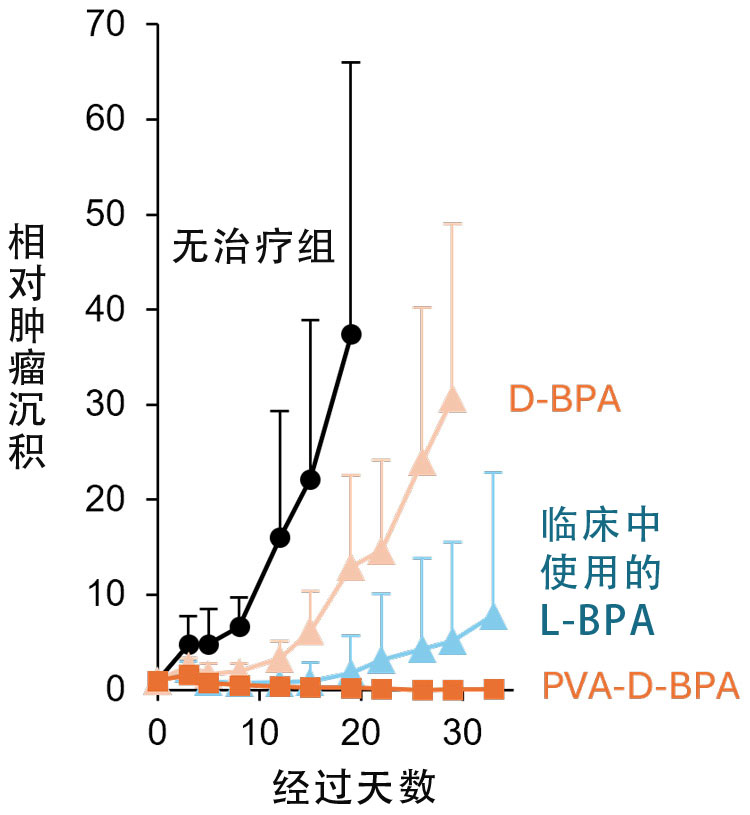
相对体积为1的癌细胞在BNCT治疗后的体积变化。临床上使用的L-BPA和添加PVA的D-BPA药物,数日内都能减少癌细胞体积。但随后加入PVA的D-BPA将癌细胞体积进一步缩小到几乎消失的水平(供图:东京大学野本贵大副教授)。
野本副教授表示:“通过与PVA组合,D-BPA有望成为治疗那些现有药物效果不足的癌症的有效药物。”未来计划通过药物标准化及更多动物实验,推动向临床应用的发展。
本研究由东京大学、京都大学和Stella Pharma公司(大阪市中央区)合作进行,并得到了日本科学技术振兴机构(JST)、日本医疗研究开发机构(AMED)、日本学术振兴会的科学研究补助金项目及Stella Pharma公司合作研究的经费支持。相关成果于2024年12月3日发表在药物递送系统(DDS, Drug Delivery System)专业期刊《Journal of Controlled Release》电子版上。
日文:JST Science Portal 编辑部
中文:JST客观日本编辑部
【论文信息】
期刊:Journal of Controlled Release
论文:Poly(vinyl alcohol) potentiating an inert D-amino acid-based drug for boron neutron capture therapy
DOI:10.1016/j.jconrel.2024.11.017